Xanthomonas campestris: descripción, cultivo y patologías
Xanthomonas campestris es una especie de proteobacteria (clase: Gamma Proteobacteria, orden: Xantomonadales, familia: Xanthomonadaceae) fitopatógena que afecta a cultivos importantes.
X. campestris presenta una fase epífita sobre la planta en la cual no le hace daño. Esta fase es previa a la infección, se genera al proliferar la bacteria por variaciones ambientales favorables. La infección por esta especie ocasiona una variedad de síntomas en la planta infectada que pueden degenerar finalmente en su muerte.

X. campestris es también muy conocida por producir el biopolímero goma xantano o xantano, un polisacárido que excreta al medio (exopolisacárido) y aumenta la viscosidad de las soluciones acuosas.
El exopolisacárido xantano fue el primer bioproducto de importancia comercial generado por procesos de fermentación de almidones de maíz. Actualmente se produce en grandes cantidades y tiene muchas aplicaciones por sus características como espesante y emulsionante. El xantano se utiliza en la industria alimenticia, farmacéutica, cosmética, agrícola, petrolera, entre otras.
Índice del artículo
- 1 Descripción
- 2 Aislamiento de X. campestris a partir de tejido vegetal
- 3 Medios de cultivo
- 4 Fisiopatologías
- 5 Referencias
Xanthomonas campestris es un bacilo gramnegativo, aeróbico obligado y saprofito facultativo. Es móvil, entre 0,2 y 0,6 µm de ancho, y entre 0,8 y 2,9 µm de largo. Puede presentarse como individuo solitario o formando filamentos, rodeados por el xantano, el exopolisacárido que producen.
El xantano favorece la formación de biopelículas de X. campestris y también ejerce una acción protectora de las comunidades establecidas en esta estructura, al ocurrir cambios bruscos de temperatura, de pH, de radiación ultravioleta, variaciones osmóticas marcadas y/o disminución de la humedad.
Esta especie presenta varios mecanismos para evadir las respuestas de defensas de las plantas que infecta. La primera barrera de la planta ante una infección bacteriana es la pared celular y las sustancias superficiales con actividad antimicrobiana.
X. campestris puede infectar a la planta a través de sus estomas foliares (poros donde ocurre el intercambio de gases con el ambiente), de sus hidátodos (un tipo de estoma por donde exuda el exceso de agua), o de heridas presentes.
Generalmente las plantas cierran sus estomas al ser atacadas por microorganismos. Sin embargo, X. campestris produce un factor de virulencia que impide el cierre de los estomas, favoreciendo así la entrada a la planta de más bacterias desde el medio externo.
Al encontrarse las bacterias dentro de la planta, impiden el transporte de agua, por obstruir los tejidos vasculares. El resultado es la necrosis de las hojas y la marchitez de las partes infectadas.
Además, X. campestris produce un compuesto denominado glucano cíclico neutro β-(1,2) que impide la expresión de genes de defensa en la planta. Estos compuestos pueden encontrarse asociados al espacio periplasmático bacteriano o pueden ser excretados al medio extracelular, favoreciendo la movilidad de la bacteria, su virulencia y la formación de biopelículas.
El xantano producido por las Xanthomonas actúa como factor de virulencia, suprimiendo la respuesta inmunológica de la planta infectada y aumentando la capacidad de infección de la bacteria.
El xantano es un polisacárido constituido por unidades de 5 azúcares que se repiten (2 glucosas, 2 manosas y 1 ácido glucurónico) y se polimerizan.
La síntesis de xantano depende de un operón denominado cluster gum (un conjunto de genes que conforman una unidad funcional), el cual presenta 12 genes que están bajo el control de una única región promotora.
X. campestrispv. campestris puede aislarse del tejido foliar que presente manchas en forma de “V” o del tejido vascular dañado, o cuello de la planta, es decir de las zonas lesionadas de la planta.
Para obtener cepas de X. campestris, se selecciona como muestra la zona lesionada (manchas foliares o en los frutos o chancros). En caso de no observarse lesión en la planta, se toma como muestra el tejido más susceptible a ser dañado, y se analizan por medios de cultivo y por la técnica de reacción en cadena de la polimerasa (PCR).
Entre los medios de cultivo utilizados se encuentran los siguientes:
Para un aislamiento inicial de microorganismos a partir de muestras de tejido vegetal, se puede aplicar el medio Milk Tween (MT):
10 ml de leche descremada, 0,25 g de CaCl2, 10g de proteasa peptona No. 3, 15 g de Bacto agar, 0,5 g de tirosina, 10ml de Tween 80, 80 mg de cefalexina (en 2ml de NaOH al 4%), 200 gr de cicloheximida (en 2ml de metanol al 75%), 100 mg de vancomicina (en 1 ml de agua destilada).
Las soluciones de leche descremada, cefalexina, cicloheximida y vancomicina se deben esterilizar por filtración y agregar al medio a 50°C.
Tras dejar crecer las colonias bacterianas en el MT, se pueden pasar las más parecidas a X. campestris (colonias de pigmentación amarilla a las 72 y 120 horas de cultivo) al medio B de King:
20 g de proteasa peptona No.3, 20 g de agar agar, K2HPO4 1,5 g, MgSO4x/H2O 1,5g, 10 ml de glicerol, 700 de agua destilada.
El medio debe calentarse a 80 °C agitando, aforar con agua destilada a 1 L y homogeneizar, y se debe ajustar el pH a 7,2. Esterilizar a 121°C por 15 minutos.
También se ha utilizado el medio de cultivo rico PYM o el YMM en el cultivo de X. campestris.
Para preparar el PYM, por cada 1000 ml de volumen total, se debe agregar: 10 gr de glucosa, 5 gr de extracto de peptona, 3 gr de extracto de malta y 3 gr de levadura.
Si se desea cultivar en medio sólido en placas de Petri, entonces también se debe agregar a la mezcla 15 gr de agar.
Para preparar el medio YMM, se necesita por cada 1000 ml de volumen total: 10 gr de glucosa, 1 ml de solución MgSO4:7H2O (10 g/L), 1 ml de una solución CaCl2 (22 gr/L), 1 ml de una solución K2HPO4 (22 gr/L), 1 ml de una solución FeCl3 en 0,1 M de HCl (2 g/L), casaminoácidos 0,3 % m/v (aminoácidos provenientes de la hidrólisis de la caseína) y un 11% v/v de solución de glutamato de sodio.
Las condiciones de incubación de las cepas bacterianas de X. campestris deben ser de 27 o 28 °C, y en caso de medios de cultivo líquidos debe mantenerse la agitación continua a 200 revoluciones por minuto (rpm).
Si se desea la producción de xantano en un proceso de fermentación, se debe suministrar como fuente de carbono glucosa, sacarosa, o jarabe de maíz (entre 20 y 40 g/L), entre otros nutrientes que aporten nitrógeno.
Para detectar la presencia de X. campestris viable en tejido vegetal, algunos investigadores recomiendan medir la actividad metabólica, en lugar del crecimiento microbiano en cultivo en laboratorio.
La medición de la actividad metabólica se ha realizado usando un indicador de viabilidad a través del sistema transportador de electrones. Este compuesto es llamado tetrazolio y sus sales aceptan electrones del hidrógeno, generando el formazan, una sustancia insoluble en agua. Así, la aparición en el medio del formazan es un indicador de la actividad metabólica celular.
Uno de los medios de cultivo de X. campestris para realizar esta prueba de viabilidad, contiene cloruro de tetrazolio (TTC), trifenil cloruro de tetrazolio y otros aditivos como cloruro de sodio y azúcares. Se trata de un medio con las siguientes sustancias para 500 ml de volumen total: 5 g de peptona, 0,5 g de caseína hidrolizada, 2,5 g de glucosa y 8,5 g de agar.
La bacteria X. campestris es agente causal de numerosas enfermedades que afectan las hojas de plantas ornamentales (como Anthurium andreanum) y de frijol común (Phaseolus vulgaris L.). También afectan los frutos de frutales de hueso, como almendro, nectarino, cerezo, melocotonero, albaricoque, ciruelo, entre otros.
X. campestris es conocido por afectar a la familia Brassicaceae o crucíferas, encontrándose entre las 10 especies fitopatógenas de mayor peligrosidad para la actividad agrícola, particularmente en el trópico.
Por ejemplo, X. campestris produce la enfermedad de la podredumbre negra en la coliflor (Brassica oleracea), el brécol (B. napus), la col china (B. pekinensis), el nabo (B. rapa), la mostaza (B. nigra), el rábano (Rhaphanus sativus) y el repollo (B. fruticulosa).
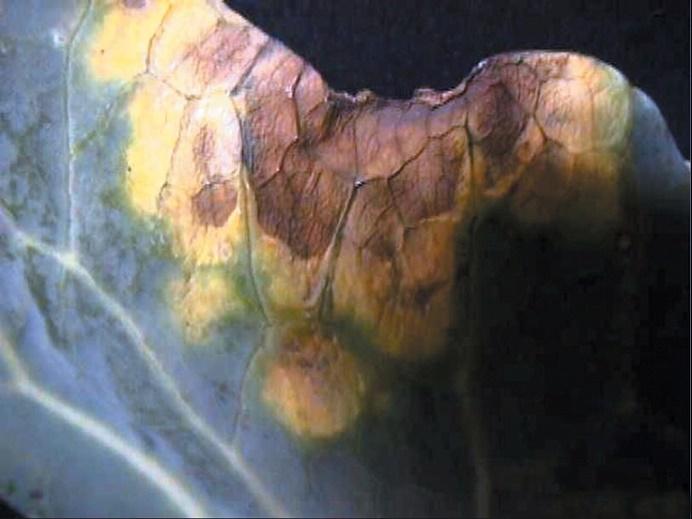
Los síntomas que produce X. campestris aparecen inicialmente en hojas y luego pueden aparecer en los frutos y las ramas. Implican manchas foliares amarillentas irregulares y angulosas (de 1 a 5 mm de diámetro) limitadas por las nervaduras que se necrosan finalmente.
También se presentan quemaduras foliares; manchas en los frutos; marchitez vascular y la aparición de lesiones cloróticas o necróticas en forma de “V”.
Las manchas aparecen en los bordes foliares y rodeando su nervio central. Puede producirse la pérdida de las hojas en la planta. En los frutos aparecen manchas verdes que se necrosan, pudiendo también agrietarlos. También pueden presentarse chancros.
- Dow, J. M., Crossman, L., Findlay, K., He, Y.-Q., Feng, J.-X., & Tang, J.-L. (2003). Biofilm dispersal in Xanthomonas campestris is controlled by cell-cell signaling and is required for full virulence to plants. Proceedings of the National Academy of Sciences, 100(19), 10995–11000. doi:10.1073/pnas.1833360100
- Hayward, A. C., Swings, J. G. and Civerolo, E. L. (1993). Xanthomonas. Springer Netherlands. pp 407.
- Papagianni, M., Psomas, S., Batsilas, L., Paras, S., Kyriakidis, D. and Liakopoulou-Kyriakides, M. (2001). Xanthan production by Xanthomonas campestris in batch cultures. Process Biochemistry, 37(1), 73–80. doi:10.1016/s0032-9592(01)00174-1
- Rosalam, S., & England, R. (2006). Review of xanthan gum production from unmodified starches by Xanthomonas campestris Enzyme and Microbial Technology, 39(2), 197–207. doi:10.1016/j.enzmictec.2005.10.019
- Stewart, P. and Globig, S. (2011). Phytopathology in plants. Apple Academic Press. pp 334.
