Carbonato de litio (Li2CO3): estructura, propiedades, usos
El carbonato de litio es un sólido inorgánico formado por dos cationes litio Li+ y un anión carbonato CO32–. Su fórmula química es Li2CO3. El Li2CO3 es un sólido cristalino blanco que se puede obtener por la reacción entre el hidróxido de litio y el dióxido de carbono.
El carbonato de litio posee un punto de fusión muy alto, por lo que se usa en la preparación de vidrios, cerámicas y porcelanas. Tiene muy variados usos, como por ejemplo en baterías recargables de litio, en la preparación de otros compuestos de litio, en electrodos para soldar y en pinturas y barnices.

También se emplea el Li2CO3 en las mezclas de cemento para lograr un fraguado rápido y en la producción de aluminio.
Uno de sus usos más importantes es en el tratamiento de algunas enfermedades mentales como la depresión y conductas excesivamente agresivas, entre otras afecciones.
Sin embargo, su utilización como medicamento debe ser debidamente controlada por especialistas médicos pues las personas tratadas con Li2CO3 pueden sufrir efectos dañinos para la salud, como por ejemplo hipotiroidismo (función reducida de la glándula tiroides).
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades físicas
- 4 Propiedades químicas
- 5 Propiedades biológicas
- 6 Obtención
- 7 Usos
- 8 Efectos adversos
- 9 Otros usos
- 10 Referencias
El carbonato de litio está formado por dos cationes litio Li+ y un anión carbonato CO32–.
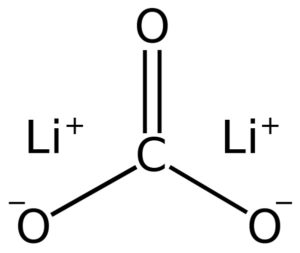
La configuración electrónica del litio en estado de oxidación +1 es 1s2 2s0, pues ha perdido el electrón de la última capa, siendo así más estable. El ion carbonato CO32– posee una estructura plana.
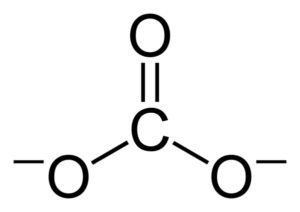
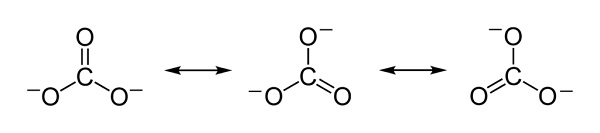
Las cargas negativas se encuentran distribuidas de forma equitativa entre los tres átomos de oxígeno del ion carbonato CO32–.
-Carbonato de litio
-Carbonato de dilitio
Sólido blanco cristalino de estructura monoclínica
73,9 g/mol
723 ºC
Se descompone a 1300 ºC.
2,11 g/cm3
Poco soluble en agua: 1,31 % en peso a 20 ºC. Su solubilidad en agua disminuye al aumentar la temperatura. Es soluble en ácidos diluidos. Es insoluble en alcohol y en acetona.
Las soluciones en agua son alcalinas, poseen un pH mayor a 7.
El Li2CO3 se hidroliza en solución acuosa generando una solución básica. La pequeña proporción del compuesto que se solubiliza en agua deja libre el anión carbonato CO32–.
El anión carbonato CO32– libre en solución acuosa toma un protón para formar el anión bicarbonato HCO3–, como se puede observar en la siguiente reacción:
CO32– + H2O → HCO3– + OH–
La presencia de iones OH– es lo que hace que la solución sea básica.
En los tejidos animales y humanos hay normalmente trazas de ion litio, pero hasta los momentos no se conoce ningún rol fisiológico natural de este ion.
En el organismo humano el Li2CO3 ingerido como medicamento, actúa sobre una variedad de mecanismos de señalización en las neuronas y otras células. Esto resulta de la sustitución de cationes como el sodio y el potasio.
La incorporación del ion litio a la estructura de la membrana celular puede alterar la respuesta hacia las hormonas y el acoplamiento de la célula con procesos energéticos.
De esta forma el litio modifica varios procesos celulares incluyendo el metabolismo.
A través de la modificación de la forma en que funcionan las células el Li2CO3 puede actuar sobre los mecanismos de comunicación de las neuronas en el cerebro.
El Li2CO3 se puede obtener por la reacción del hidróxido de litio LiOH con el dióxido de carbono CO2, según se muestra a continuación:
2 LiOH + CO2 → Li2CO3 + H2O
Comercialmente se produce a partir de minerales que contienen litio como el espodumeno y la lepidolita. Se tratan estos minerales a altas temperaturas con ciertas sales de sulfato o con compuestos alcalinos para obtener sales de litio.
Las sales de litio obtenidas se purifican con agua o soluciones ácidas y luego se tratan con carbonatos para formar Li2CO3.
Sin embargo, el Li2CO3 conseguido de esta forma queda contaminado con sulfatos o cloruros de calcio, magnesio, hierro, sodio, potasio, etc. por lo que requiere una purificación posterior.
Se usa como agente antidepresivo, antimaníaco, en el tratamiento de conductas agresivo-impulsivas y para desórdenes bipolares (personas que cambian de humor repentinamente sin causa alguna, llegando a ser violentas).

Los médicos han observado que su administración conduce a la disminución de la intensidad y frecuencia de los períodos severos de depresión y episodios maníacos.
Se emplea solo, es decir, sin ningún compuesto añadido, en la terapia de mantenimiento de la depresión unipolar y para el desorden esquizoafectivo. También sirve para aumentar el efecto antidepresivo de otros medicamentos.
Aunque ha sido usado para tratar niños con síntomas aparentes de desorden bipolar e hiperactividad con componentes neuróticos o de agresividad, no ha sido efectivo en todos los casos.
Es utilizado para disminuir la frecuencia de fuertes dolores de cabeza, recurrentes y crónicos.
Se emplea para reducir la incidencia de infección en pacientes con neutropenia inducida por quimioterapia o por otras razones. La neutropenia es la disminución de los neutrófilos, un tipo de glóbulos blancos que ayudan a combatir infecciones en el organismo.
Ha sido usado como inhibidor de enzimas tiroideas para el tratamiento del hipertiroidismo, pero no es el tratamiento preferido debido a sus efectos adversos.
Se usa en forma de tabletas o cápsulas de Li2CO3. También en tabletas de liberación lenta con citrato de litio. Se prefiere el Li2CO3 debido a que no irrita la garganta al tragarlo, como sí ocurre con otras sales de litio.
El Li2CO3 puede tener un efecto dañino sobre la tiroides y los riñones por lo que debe monitorearse la función de estos órganos antes y durante el tratamiento con este compuesto.
El Li2CO3 puede ser tóxico a concentraciones muy cercanas a las empleadas en los tratamientos médicos, por lo que se requiere una continua revisión de sus valores en suero sanguíneo.
Los síntomas de intoxicación con Li2CO3 son temblores, espasmos musculares, debilidad muscular, diarrea, vómitos, somnolencia o ataxia (deterioro en la coordinación muscular), entre otros.
Al iniciarse la terapia con Li2CO3 también pueden presentarse síntomas como por ejemplo temblores, dolores de cabeza y náuseas. Pero estos tienden a desaparecer al continuar la medicación.
La mayoría de las personas tratadas también puede desarrollar leucocitosis (aumento en el número de glóbulos blancos), pero esta es reversible.
Las personas que están siendo medicadas con Li2CO3 no deben manejar vehículos ni operar maquinarias, debido a que disminuye la coordinación física y la habilidad de realizar actividades que requieren estar alerta.
No debe usarse en niños menores de 12 años, pues puede interferir en la formación de los huesos y su densidad, ya que altera las concentraciones de una hormona de la tiroides. Además tiende a ocupar el lugar del calcio en los huesos.
No deben tratarse con Li2CO3 las personas con enfermedad cardiovascular, de los riñones o de la tiroides. Tampoco en pacientes severamente deshidratados.
No debe administrarse a mujeres embarazadas especialmente durante el primer trimestre del embarazo. El litio atraviesa la placenta y puede llegar hasta el feto con facilidad con posibles efectos teratogénicos, esto es, puede producir anomalías o malformaciones en el bebé que se está gestando.
Las personas ancianas que requieren tratamiento con Li2CO3 deben tratarse con sumo cuidado y con dosis inferiores a las de los adultos jóvenes, pues pueden desarrollar enfermedad de hipotiroidismo.
El Li2CO3 de alta pureza se usa ampliamente en la fabricación de baterías recargables de litio.
Se utiliza en celdas de combustible de carbonato fundido.
Es empleado en la fabricación de porcelana eléctrica que es un tipo de porcelana aislante de la electricidad. También se utiliza en la producción de vidriado sobre cerámica.

Permite preparar cerámica con bajo coeficiente de expansión, esto es, que se expande muy poco al aumentar la temperatura, por lo que la cerámica puede usarse en un intervalo de temperatura mayor.
Otros de sus usos son como catalizador, en la manufactura de otros compuestos de litio, como recubrimiento de electrodos de soldadura, en fórmulas de pintura luminiscente, barnices y colorantes, así como en la producción electrolítica de aluminio.
Es útil para generar un fraguado más rápido del cemento y se agrega al pegamento de tejas para que estas se puedan fijar en corto tiempo.

- Cai, W. et al. (2018). Removal of SO42- from Li2CO3 by Recrystallization in Na2CO3. Crystals 2018, 8, 19. Recuperado de mdpi.com.
- Gadikota, G. (2017). Connecting the Morphological and Crystal Structural Changes during the Conversion of Lithium Hydroxide Monohydrate to Lithium Carbonate Using Multi-Scale X-ray Scattering Measurements. Minerals 2017, 7, 169. Recuperado de mdpi.com.
- U.S. National Library of Medicine. (2019). Lithium Carbonate. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
