Yoduro de plomo: estructura, propiedades, obtención, usos
El yoduro de plomo es un compuesto inorgánico formado por el elemento plomo (Pb) en su estado de oxidación +2 y el yodo (I) con valencia -1. Su fórmula química es PbI2. Es un compuesto tóxico. Por poseer plomo es dañino para el ser humano, animales y ecosistemas naturales. Además, el yoduro también puede causar algunas enfermedades.
El compuesto PbI4, esto es, con el plomo en estado de oxidación +4, parece ser que no existe, debido probablemente a la capacidad reductora del ion yoduro (I–). El PbI2 es un sólido color amarillo oro poco soluble en agua.

Se puede obtener utilizando una reacción de intercambio iónico entre una sal de yoduro y una de plomo que sean ambas solubles en agua.
Tiene propiedades de semiconductor, por lo que la mayoría de sus aplicaciones actuales es en dispositivos fotovoltaicos, detectores de ciertas radiaciones y sensores.
Uno de los usos más estudiados de este compuesto es el de celdas solares de perovskita, las cuales han demostrado ser muy eficientes y de bajo costo.
Índice del artículo
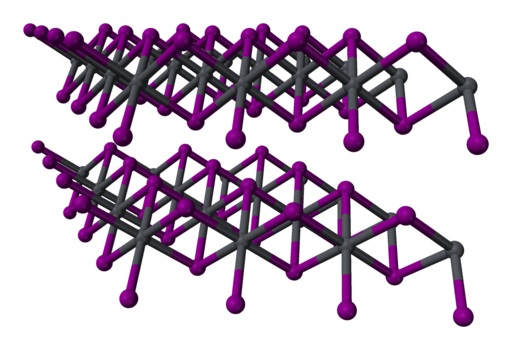
En el yoduro de plomo la unión entre sus átomos es iónica solo en parte. Los átomos forman capas con estructura hexagonal y éstas están unidas entre sí mediante débiles fuerzas de Van der Waals.
Estas fuerzas no son ni iónicas ni covalentes, son interacciones débiles entre las capas electrónicas de los átomos.
- Yoduro de plomo
- Yoduro de plomo (II)
- Diyoduro de plomo
- Yoduro plumboso
Sólido cristalino amarillo brillante. Cristales hexagonales.

461 g/mol
410 ºC
954 °C, hierve con descomposición.
6,16 g/cm3
Ligeramente soluble en agua: 0,076 g/100 mL a 25 °C. Soluble en agua caliente. Insoluble en alcohol y en ácido clorhídrico (HCl) frío.
Sus propiedades oxidantes y reductoras son débiles. Sin embargo, puede presentar reacciones de oxidoreducción.
Aunque es muy poco soluble en agua se disuelve en soluciones concentradas de yoduros alcalinos como el yoduro de potasio (KI). Es soluble en solución concentrada de acetato de sodio (CH3COONa). Se disuelve libremente en solución de tiosulfato de sodio (Na2S2O3).
Algunos autores indican que en agua se puede generar el ion PbI+ y si hay exceso de ion yoduro (I–) se pueden formar especies más complejas como PbI3– y PbI42-, entre otras.
No es inflamable.
Se comporta como un semiconductor, es decir, que puede o no conducir la electricidad dependiendo de las condiciones a las cuales esté sometido.
Es un semiconductor de gap directo, es decir, que para que uno de sus electrones pueda pasar desde la banda de valencia hacia la de conducción solo debe tener una cantidad de energía igual al ancho de banda prohibida.
Debido al alto número atómico de sus elementos (Pb=82, I=53) tiene una alta capacidad fotoeléctrica. Su banda de brecha de 2,5 eV permite desempeños fotovoltaicos de alta eficiencia a temperaturas de hasta 250 °C.
Se puede preparar haciendo reaccionar un compuesto de plomo soluble en agua con ácido yodhídrico (HI) o con un yoduro metálico soluble. Por ejemplo, se mezcla una solución acuosa de acetato de plomo con yoduro de potasio:
Pb(CH3COO)2 + 2 KI → PbI2↓ + 2 K(CH3COO)
Este tipo de reacción se conoce como “intercambio iónico” porque los cationes y aniones se intercambian entre las sales.
En el ejemplo mencionado el acetato de potasio es muy soluble en agua y permanece disuelto, mientras que el yoduro de potasio, siendo menos soluble, precipita y se puede filtrar. La purificación se realiza recristalizando el compuesto en agua.
La precipitación del PbI2 se puede observar en la siguiente imagen que muestra un tubo de ensayo donde se mezclaron nitrato de plomo (II) (Pb(NO3)2) y yoduro de potasio (KI) en solución acuosa. Este efecto se denomina “lluvia de oro”.

Se usa como detector para fotones de alta energía tales como los de rayos X y rayos gamma. Puede emplearse en dispositivos fotovoltaicos, fotoceldas, luces LED, detectores ópticos y en sensores para clasificación y diagnóstico biológico.
Si se introduce en nanoestructuras puede utilizarse en fotocatálisis y celdas solares. Además, muchas nanopartículas de PbI2 tienen propiedades luminiscentes.

El PbI2 es un intermediario en la síntesis de perovskitas destinadas a celdas solares. Este tipo de celdas fotovoltaicas contienen yoduro de metilamonio y plomo (CH3NH3PbI3) sobre una base de TiO2.
Tales dispositivos poseen una alta eficiencia y bajo costo, por lo que han sido motivo de mucho estudio e investigación.

Sin embargo, puesto que el CH3NH3PbI3 puede descomponerse con el agua de lluvia, se ha estudiado qué tan contaminantes pueden ser estas celdas tanto cuando están en uso como cuando son descartadas.
El CH3NH3PbI3 al entrar en contacto con el agua se descompone en metilamina (CH3NH2), ácido yodhídrico y PbI2. Este último, aunque es poco soluble en agua, con el tiempo puede liberar cantidades del tóxico ion Pb2+.
Los estudios no son concluyentes, pues hay que tomar en cuenta el lugar donde ocurre la liberación del plomo para determinar si la cantidad puede ser dañina a corto plazo. Por otra parte, una liberación continuada puede bioacumularse y ser muy peligrosa.
- Se siembra en forma de aerosol en las nubes para producir lluvia.
- En filtros para astronomía del lejano infrarrojo.
- En fotografía, impresiones, películas para grabar imágenes ópticas, emulsiones fotográficas.
- En revestimiento para frenos. En grasas lubricantes.
- Lámparas de arco de vapor de mercurio. En papel electrosensible.
- Materiales termoeléctricos, baterías térmicas con yodo.
Debe almacenarse lejos de oxidantes como percloratos, peróxidos, permanganatos, cloratos y nitratos. También debe evitarse el contacto con metales químicamente activos como potasio, sodio, magnesio y zinc. En todos estos casos puede ocurrir una reacción violenta.
Si se somete a fuerte calentamiento se generan gases venenosos de plomo y yodo.
Es muy dañino para el ser humano. Se ha confirmado que es carcinógeno para los animales, por ende, se deduce razonablemente que lo sea también para el ser humano.
Puede causar dolor de cabeza, irritabilidad, reducir la memoria y perturbar el sueño. El plomo contenido en este compuesto puede generar daño permanente en los riñones, cerebro, nervios, células sanguíneas y riesgo de presión alta.
Debe manejarse como un teratógeno (compuesto que puede generar un defecto congénito). Además puede producir yodismo, cuyos síntomas son congestión de las fosas nasales, dolor de cabeza, irritación de las membranas mucosas y erupción cutánea, entre otros.
Está clasificado como contaminante tóxico. Debe mantenerse lejos de fuentes de agua y desagües. Para evitar que contamine se deben construir diques siempre que sea necesario retenerlo.
Es muy tóxico para la vida acuática con efectos que perduran en el tiempo, pues es bioacumulable.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- U.S. National Library of Medicine. (2019). Lead iodide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Synthesis and Characterization of PVP/PbI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Recuperado de link.springer.com.
- Ismail, R.A. et al. (2016). Synthesis of PbI2 nanoparticles by laser ablation in methanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Recuperado de link.springer.com.
- Azo Materials. (2013). Lead Iodide (PbI2) Semiconductors. Recuperado de azom.com.
- CDH (2008). Lead(II) Iodide. Material Safety Data Sheet. Recuperado de chdfinechemical.com.
- Hailegnaw, B. et al. (2015). Rain on Methylammonium Lead Iodide Based Perovskites: Possible Environmental Effects of Perovskite Solar Cells. J. Phys. Chem. Lett. 2015, 6, 9, 1543-1547. Recuperado de pubs.acs.org.
- Wikimedia Foundation (2020). Lead(II) iodide. Recuperado de en.wikipedia.org.
