Transformaciones la materia: qué son, estados fundamentales, ejemplos

¿Qué son las transformaciones de la materia?
Las transformaciones de la materia son las alteraciones que sufre esta sin que su composición cambie. Es decir, la materia se transforma cuando atraviesa por cambios físicos y químicos.
Ejemplos de cambios físicos son la formación de hielo cuando desciende la temperatura, el rocío sobre las hojas que aparece en las mañanas, la dilatación de los objetos al calentarse y la magnetización de un cuerpo.
Por su parte, la oxidación de tornillos y clavos es un cambio químico, puesto que el óxido es una sustancia diferente al hierro original. En todo caso, son necesarios cambios en la energía para que estas transformaciones tengan lugar.
La transformación del hielo es un cambio de estado en el cual el agua se solidifica, pero hay más posibilidades. La materia se presenta en la naturaleza y en el laboratorio en diversos estados, de los cuales gas, líquido y sólido son los tres más comunes, al menos bajo las condiciones terrestres.
Pero, dado que la materia es cambiante, los científicos se han encontrado con más estados, de naturaleza un tanto exótica, sobre bases experimentales y teóricas.
Se puede afirmar que hay cinco estados fundamentales de la materia:
- Sólido
- Líquido
- Gas
- Plasma
- Condensado de Bose-Einstein
De ellos, los tres primeros son estables en las condiciones de nuestro planeta, mientras que los dos últimos requieren de medios tecnológicos para producirse, aunque en el universo sí son frecuentes. El plasma es, de hecho, el estado más común de la materia en el cosmos.
Los estados fundamentales de la materia
En las condiciones de presión y temperatura de la Tierra, la materia se presenta normalmente en tres estados: sólido, líquido y gas, mientras que los estados de plasma y condensado de Bose-Einstein se obtienen en condiciones diferentes, que pueden lograrse en el laboratorio.
Para explicar el por qué, es necesario recordar que la materia está compuesta de partículas, vinculadas a través de fuerzas, tanto atractivas como repulsivas. Las fuerzas de atracción, como su nombre lo indica, tienden a juntar las partículas, mientras que las repulsivas tienen el efecto opuesto.
Sólidos, líquidos y gases
Cuando prevalecen las fuerzas de atracción entre las partículas, estas se mantienen próximas entre sí, unidas en posiciones más o menos fijas, dando lugar a los sólidos. Las partículas pueden vibrar, pero no abandonar su posición dentro del sólido, por lo tanto, este mantiene una forma y un volumen definidos.
En los líquidos, las fuerzas de atracción permiten que las partículas continúen en proximidad, pero son menos intensas que en los sólidos al brindarles la posibilidad de “resbalar” entre sí de cierta forma. Por tal motivo, los líquidos adaptan su forma al recipiente que los contiene, pero mantienen su volumen fijo.
Por último, en los gases, las fuerzas atractivas son aún más débiles, predominando las fuerzas de repulsión. Esto hace que las partículas se mantengan bien alejadas unas de otras, y con mucha más libertad de movimiento. Por esta razón, los gases se expanden hasta ocupar completamente el volumen disponible.
Plasma y condensado de Bose-Einstein
Al calentar suficientemente un gas, iones y electrones se separan en un proceso llamado ionización, de esta manera se obtiene un plasma en el laboratorio. El estado de plasma no es fácil de ver en forma natural cerca de la Tierra, pero sí puede apreciarse desde ella en las auroras boreales y australes.

Este hermoso fenómeno natural se da cuando las partículas del viento solar, un plasma bastante difuso, inciden contra la atmósfera terrestre, ionizándose.
Al otro extremo de la escala, enfriando bastante un material, apenas por encima del cero absoluto, aparece un nuevo estado de la materia en el que la mayoría de las partículas se encuentra en el estado fundamental, que es el de más baja energía.
Este estado de la materia recibe el nombre de condensado de Bose-Einstein, por los físicos Satyendra Bose y Albert Einstein, quienes predijeron su existencia en 1924.
Muchos años después, en 1995, varios científicos consiguieron llevar gases muy diluidos a este estado, una tarea nada fácil, considerando que se requieren temperaturas de apenas nano-kelvin por encima del cero absoluto.
Cambios de estado en la materia
En la naturaleza, es muy frecuente que la materia pase de un estado a otro. Normalmente, estos cambios físicos se deben a variaciones en la presión y la temperatura, derivadas del aumento o disminución en la energía de las partículas.
Cuando se agrega energía térmica a un material, aumenta la energía cinética de sus partículas, disminuyendo la fuerza de atracción que las mantiene en cohesión. Si el material se encontraba en estado sólido, puede entonces pasar al estado líquido, o inclusive, ir directamente al estado gaseoso.
Al contrario, quitando suficiente energía térmica, es posible lograr que un material gaseoso se transforme a líquido, o que pase de líquido a sólido. En cualquier caso, la composición de la sustancia no cambia.
El ejemplo más familiar para todos es el agua: es bien conocido que una porción de agua líquida se transforma en vapor cuando se hierve, mientras que pasa a hielo enfriándola en un congelador.
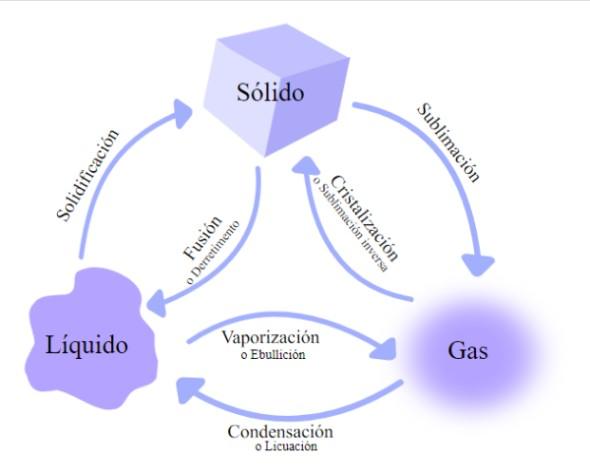
Existen varios tipos de cambio por los que pasa la materia, clasificados según si la energía térmica aumenta o disminuye:
- Progresivos, tienen lugar cuando el material absorbe energía térmica.
- Regresivos, son los que ocurren cuando el material cede energía.
Transformaciones progresivas
Entre las distintas transformaciones progresivas que tienen lugar en la materia al agregarle energía, se encuentran:
Fusión
Cambio que ocurre cuando el material pasa de su fase sólida a su fase líquida. Por ejemplo, al derretir un bloque de hielo o calentar mantequilla o cera en una sartén.
Vaporización
En este caso, la materia se transforma pasando del estado líquido al estado gaseoso.
La vaporización ocurre de dos maneras:
- Ebullición, tiene lugar cuando el material alcanza su temperatura de ebullición, de esta manera, la energía es suficiente para vencer las fuerzas intermoleculares que mantienen a las partículas en su estado líquido. Cada sustancia tiene una temperatura de ebullición característica, a una determinada presión.
- Evaporación, solamente las partículas superficiales cambian de estado, debido a que el material no está a la temperatura necesaria para entrar en ebullición. El ejemplo más conocido es la evaporación del agua dejada en un recipiente, a temperatura ambiente.
Volatilización
Llamada también sublimación, tiene lugar cuando el material se convierte directamente de sólido a gas, sin pasar por la fase líquida.
Por ejemplo, el hielo seco es dióxido de carbono CO2 que se volatiliza a temperatura ambiente. La naftalina, que se usa para proteger la ropa de los insectos, pasa lentamente de ser sólido a ser un gas.
Ionización
Es el paso de un gas a plasma.
Transformaciones regresivas
Son las transformaciones originadas por la disminución en la energía térmica de las partículas. Entre ellas se encuentran:
Solidificación
Es el cambio de la materia desde el estado líquido al sólido por enfriamiento, tal como sucede al colocar agua en el congelador. El proceso se debe a que la sustancia cede energía al entorno frío, formando hielo.
Condensación
Ocurre al pasar del estado gaseoso a la fase líquida, como sucede con el vapor de agua en el aire, al hacer contacto con la superficie fría del parabrisas del automóvil.
Licuefacción
Es la transformación de la materia al pasar de gas a líquido, tal como sucede enfriando amoníaco o dióxido de carbono a alta presión.
Sublimación inversa
Este es el paso de materia en estado gaseoso a sólido, tal como ocurre con el yodo gaseoso que choca contra una superficie fría, dando como resultado la formación de cristales sólidos. También se la conoce como cristalización.
Desionización
Cambio del estado plasmático al estado gaseoso.
Referencias
- Chang, R. (2013). Química. 11va. Edición. McGraw Hill Educación.
- Giancoli, D. (2006=. Physics: Principles with Applications. 6th. Ed Prentice Hall.
- La materia y sus propiedades. Recuperado de: elbibliote.com.
- Openstax. Chemistry. Recuperado de: openstax.org.
- Shipman, J. (2009). An Introduction to Physical Science. Twelfth edition. Brooks/Cole, Cengage Editions.
