Alcohol primario: estructura, propiedades, nomenclatura, ejemplos
Un alcohol primario es aquel en el cual el grupo hidroxilo está enlazado a un carbono primario; este es, un carbono unido covalentemente a otro carbono e hidrógenos. Su fórmula general es ROH, específicamente RCH2OH, ya que solo hay un grupo alquilo R.
El grupo R de la fórmula RCH2OH puede ser cualquiera: una cadena, un anillo, o heteroátomos. Cuando se trata de una cadena, corta o larga, se está ante los alcoholes primarios más representativos; entre ellos están el metanol y el etanol, dos de los más sintetizados a niveles industriales.

Físicamente son como los demás alcoholes, y sus puntos de ebullición o fusión dependen del grado de sus ramificaciones; pero químicamente, son los más reactivos. Además, su acidez es superior a la de los alcoholes secundarios y terciarios.
Los alcoholes primarios experimentan reacciones de oxidación, convirtiéndose en un amplio número de compuestos orgánicos: esteres y éteres, aldehídos y ácidos carboxílicos. Asimismo, pueden sufrir reacciones de deshidratación, transformándose en alquenos u olefinas.
Índice del artículo
Los alcoholes primarios derivados de alcanos lineales son los más representativos. Empero, en la realidad cualquier estructura, sea lineal o ramificada, puede clasificarse dentro de este tipo de alcoholes siempre y cuando el grupo OH esté enlazado a un CH2.
Entonces, estructuralmente todos tienen en común la presencia del grupo –CH2OH, llamado metilol. Una característica y consecuencia de este hecho es que el grupo OH se encuentra menos impedido; esto es, puede interactuar con el medio sin que otros átomos estorben espacialmente.
Asimismo, un OH menos impedido significa que el átomo de carbono que lo porte, el del CH2, puede sufrir reacciones de sustitución mediante un mecanismo SN2 (bimolecular, sin la formación de un carbocatión).
Por otro lado, un OH con mayor libertad de interactuar con el medio, se traduce como interacciones intermoleculares más fuertes (por puentes de hidrógeno), lo que a su vez incrementan los puntos de fusión o ebullición.
Igualmente sucede con su solubilidad en solventes polares, siempre y cuando el grupo R no sea muy hidrofóbico.
Los alcoholes primarios son de todos los más ácidos. Para que un alcohol se comporte como un ácido de Bronsted, debe donar un ion H+ al medio, a decir agua, para convertirse en un anión alcóxido:
ROH + H2O => RO– + H3O+
La carga negativa del RO–, específicamente del RCH2O–, siente menos repulsión por parte de los electrones de los dos enlaces C-H, que por los electrones del enlac C-R.
El grupo alquilo ejerce entonces la mayor repulsión, desestabilizando RCH2O–; pero no tanto en comparación a que si hubiera dos o tres grupos R, como ocurre con los alcoholes secundarios y terciarios, respectivamente.
Otra manera de explicar la mayor acidez de un alcohol primario, es mediante la diferencia de electronegatividad, creándose el momento dipolar: H2Cδ+-Oδ-H. El oxígeno atrae densidad electrónica tanto del CH2 como del H; la carga parcial positiva del carbono repele un poco la del hidrógeno.
El grupo R transfiere un poco de su densidad electrónica al CH2, lo cual ayuda a disminuir su carga parcial positiva y con ello su repulsión por la carga del hidrógeno. Mientras más grupos R haya, menor será la repulsión, y por ende, la tendencia del H a liberarse como H+.
pKa
Los alcoholes primarios son considerados ácidos más débiles que el agua, a excepción del alcohol metílico, el cual es ligeramente más fuerte. El pKa del alcohol metílico es 15,2; y el pKa del alcohol etílico es 16,0. Mientras, el pKa del agua es 15,7.
Sin embargo, el agua que es considerada un ácido débil, al igual que los alcoholes, puede unirse al H+ para transformarse en el ion hidronio, H3O+; es decir, se comporta como una base.
De la misma manera, los alcoholes primarios pueden captar hidrógeno; en especial en algunas de las reacciones que le son propias, por ejemplo, en su transformación en alquenos u olefinas.
Formación de halogenuros de alquilo
Los alcoholes reaccionan con los halogenuros de hidrógeno para producir halogenuros de alquilo. La reactividad de los alcoholes delante los halogenuros de hidrógeno, desciende en el orden siguiente:
Alcohol terciario > alcohol secundario > alcohol primario
ROH + HX => RX + H2O
RX se trata de un halogenuro de alquilo primario (CH3Cl, CH3CH2Br, etc.).
Otra forma de preparar halogenuros de alquilo es mediante la reacción del cloruro de tionilo, un reactivo sintético, con un alcohol primario que se convierte en un cloruro de alquilo. El cloruro de tionilo (SOCl2) requiere para reaccionar la presencia de la piridina.
CH3(CH2)3CH2OH + SOCl2 => CH3(CH2)3CH2Cl + SO2 + HCl
Esta reacción corresponde a la halogenación del 1-pentanol para convertirse en 1-cloropentano en presencia de piridina.
Oxidación de los alcoholes primarios
Los alcoholes pueden ser oxidados a aldehídos y a ácidos carboxílicos, dependiendo del reactivo. El clorocromato de piridinio (PCC) oxida al alcohol primario a aldehído, usando como solvente el diclorometano (CH2Cl2):
CH3(CH2)5CH2OH => CH3(CH2)5COH
Esta es la oxidación del 1-heptanol en 1-heptanal.
Mientras, el permanganato de potasio (KMnO4) oxida primeramente el alcohol a aldehído, y seguidamente oxida al aldehído a ácido carboxílico. Cuando se utiliza el permanganato de potasio para oxidar los alcoholes debe evitarse la ruptura del enlace entre los carbonos 3 y 4.
CH3(CH2)4CH2OH => CH3(CH2)4COOH
Esta es la oxidación del 1-hexanol a ácido hexanoico.
Por este método es difícil obtener un aldehído, ya que este se oxida fácilmente a un ácido carboxílico. Una situación parecida se observa cuando se utiliza el ácido crómico para oxidar los alcoholes.
Formación de éteres
Los alcoholes primarios pueden convertirse en éteres al ser calentado en presencia de un catalizador, generalmente ácido sulfúrico:
2 RCH2OH => RCH2OCH2R + H2O
Formación de esteres orgánicos
La condensación de un alcohol y un ácido carboxílico, esterificación de Fisher, catalizada por un ácido, produce un ester y agua:
R’OH + RCOOH => RCOOR’ + H2O
Una reacción muy conocida es la del etanol con el ácido acético, para dar acetato de etilo:
CH3CH2OH + CH3COOH => CH3COOHCH2CH3 + H2O
El alcohol primario es el más susceptible a sufrir reacciones de esterificación de Fischer.
Deshidratación
A temperaturas elevadas y en un medio ácido, generalmente de ácido sulfúrico, los alcoholes se deshidratan para originar alquenos con la pérdida de una molécula de agua.
CH3CH2OH => H2C=CH2 + H2O
Esta es la reacción de deshidratación del etanol a etileno. Una fórmula general más adecuada para este tipo de reacción, específicamente para un alcohol primario, sería:
RCH2OH => R=CH2 (lo que también es igual a RC=CH2)
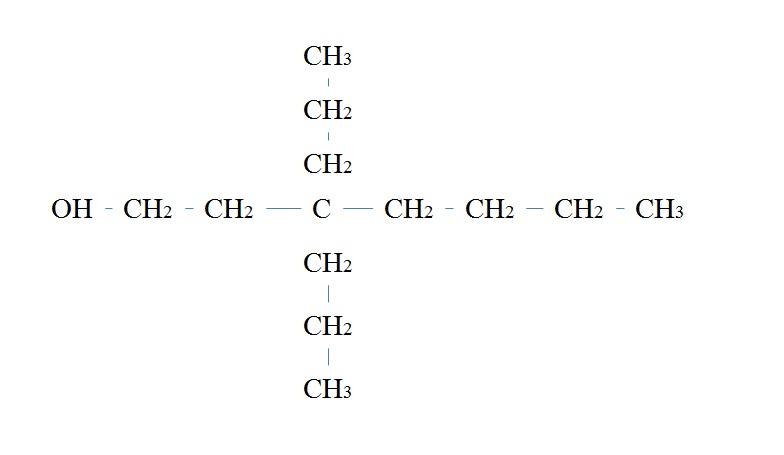
Las reglas para nombrar a un alcohol primario son las mismas que para los otros alcoholes; con la excepción, de que a veces no es necesario enumerar al carbono portador del OH.
En la imagen superior se tiene una cadena principal de siete carbonos. Al carbono enlazado con el OH se le asigna el número de 1, y entonces se empieza a contar de izquierda a derecha. Su nombre IUPAC por tanto es: 3,3-dietilheptanol.
Nótese que este es un ejemplo de un alcohol primario altamente ramificado.
Para finalizar, se mencionan algunos alcoholes primarios en función de su nomenclatura tradicional y sistemática:
-Metílico, CH3OH
-Etílico, CH3CH2OH
-n-propílico, CH3CH2CH2OH
-n-hexílico, CH3CH2CH2CH2CH2CH2OH
Estos son derivados de alcanos lineales. Otros ejemplos son:
-2-feniletanol, C6H5CH2CH2OH (C6H5 = anillo bencénico)
-2-propen-1-ol (alcohol alílico), CH2=CHCH2OH
-1,2-etanodiol, CH2OHCH2OH
-2-cloroetanol (etilenclorhidrina), ClCH2CH2OH
-2-buten-1-ol (alcohol crotílico), CH3CH=CHCH2OH
- Morrison, R.T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Química Orgánica. (6ta Edición). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). How the oxidation of primary alcohols takes place. Recuperado de: melscience.com
- Royal Society of Chemistry. (2019). Definition: primary alcohols. Recuperado de: rsc.org
- Chriss E. McDonald. (2000). The Oxidation of Primary Alcohols to Esters: Three Related Investigative Experiments. J. Chem. Educ., 2000, 77 (6), p 750. DOI: 10.1021/ed077p750
