Ciclohexeno: estructura, propiedades, síntesis y usos
El ciclohexeno es un alqueno u olefina cíclico cuya fórmula molecular es C6H10. Consiste en un líquido incoloro, insoluble en agua y miscible con muchos solventes orgánicos. Se caracteriza por ser inflamable, y en la naturaleza se suele encontrar en el alquitrán de hulla.
El ciclohexeno se sintetiza por hidrogenación parcial del benceno y mediante la deshidratación del alcohol ciclohexanol; es decir, una forma más oxidada. Al igual que otros cicloalquenos, experimenta reacciones de adición electrofílica y con radicales libres; por ejemplo, la reacción de halogenación.
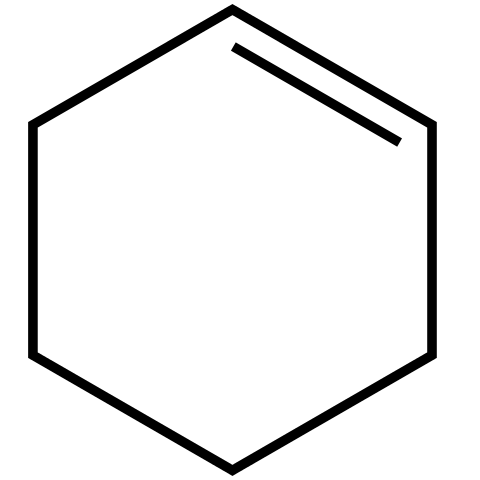
Este alqueno cíclico (imagen superior) forma mezclas azeotrópicas (no separables por destilación), con alcoholes inferiores y el ácido acético. No es muy estable en un almacenamiento prolongado, ya que se descompone bajo la acción de la luz solar y la radiación ultravioleta.
El ciclohexeno se utiliza como solvente, y por lo tanto, tiene numerosas aplicaciones, tales como: estabilizador de las gasolinas de alto octanaje y para la extracción de aceites.
Pero lo más importante, es que el ciclohexeno sirve de intermediario y materia prima para la obtención de numerosos compuestos de gran utilidad, entre ellos: la ciclohexanona, el ácido adípico, el ácido maleíco, el ciclohexano, el butadieno, ácido ciclohexilcarboxílico, etc.
Índice del artículo
- 1 Estructura del ciclohexeno
- 2 Propiedades
- 2.1 Nombres químicos
- 2.2 Peso molecular
- 2.3 Aspecto físico
- 2.4 Olor
- 2.5 Punto de ebullición
- 2.6 Punto de fusión
- 2.7 Punto de ignición
- 2.8 Solubilidad en agua
- 2.9 Solubilidad en solventes orgánicos
- 2.10 Densidad
- 2.11 Densidad del vapor
- 2.12 Presión de vapor
- 2.13 Auto-ignición
- 2.14 Descomposición
- 2.15 Viscosidad
- 2.16 Calor de combustión
- 2.17 Calor de vaporización
- 2.18 Tensión superficial
- 2.19 Polimerización
- 2.20 Umbral de olor
- 2.21 Índice de refracción
- 2.22 pH
- 2.23 Estabilidad
- 2.24 Reacciones
- 3 Síntesis
- 4 Usos
- 5 Riesgos
- 6 Referencias
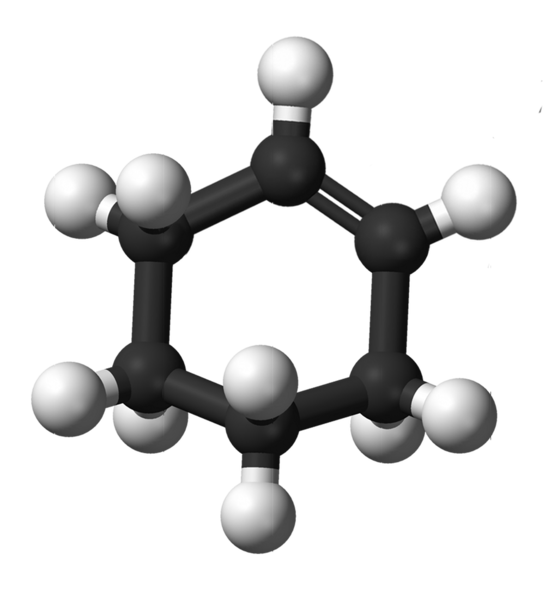
En la imagen superior se muestra la estructura del ciclohexeno con un modelo de esferas y barras. Se puede notar el anillo de seis carbonos y el doble enlace, ambos insaturaciones del compuesto. Desde esta perspectiva, pareciera que el anillo es plano; pero no lo es en absoluto.
Para empezar, los carbonos del doble enlace tienen hibridación sp2, lo cual les confiere una geometría plano trigonal. Por lo tanto, estos dos carbonos, y los adyacentes a ellos, se encuentran en un mismo plano; mientras que los dos carbonos en el extremo opuesto (al doble enlace), están arriba y debajo de dicho plano.
La imagen inferior ilustra a la perfección lo recién explicado.
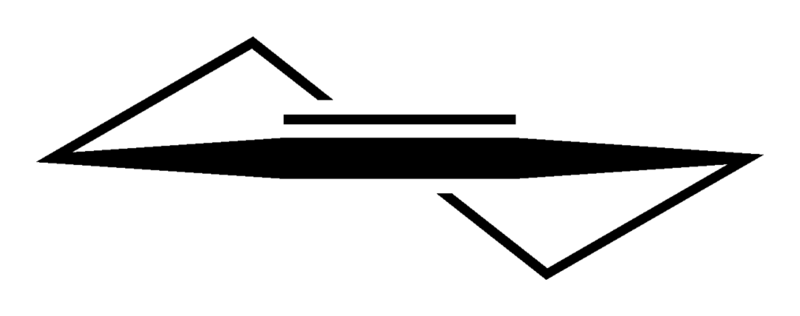
Nótese que la franja negra está compuesta de cuatro carbonos: los dos del doble enlace, y los otros adyacentes a ellos. La perspectiva expuesta es la que se obtendría si un espectador colocara su ojo justo enfrente del doble enlace. Puede verse entonces que un carbono está arriba y debajo de este plano.
Como la molécula de ciclohexeno no es estática, los dos carbonos se intercambiarán: uno bajará mientras el otro subirá por encima del plano. Así es que se esperaría que se comportara dicha molécula.
El ciclohexeno es un hidrocarburo, y por lo tanto, sus interacciones intermoleculares se basan en las fuerzas de dispersión de London.
Esto se debe a que la molécula es apolar, sin momento dipolar permanente, y su peso molecular es el factor que más contribuye en mantenerla cohesionada en el líquido.
Asimismo, el doble enlace aumenta el grado de interacción, ya que no puede moverse con la misma flexibilidad que la de los otros carbonos, y esto favorece la interacción entre moléculas vecinas. Es por esta razón que el ciclohexeno tiene un punto de ebullición un poco mayor (83ºC) que el del ciclohexano (81ºC).
Ciclohexeno, tetrahidrobenceno.
82,146 g/mol.
Líquido incoloro.
Olor dulzón.
83 ºC a 760 mmHg.
-103,5 ºC.
-7 ºC (copa cerrada).
Prácticamente insoluble (213 mg/L).
Miscible con etanol, benceno, tetracloruro de carbono, éter de petróleo y acetona. Es de esperarse que sea capaz de disolver compuestos apolares, como algunos de los alótropos del carbón.
0,810 g/cm3 a 20ºC.
2,8 (con relación al aire tomado como igual a 1).
89 mmHg a 25ºC.
244 ºC.
Se descompone en la presencia de sales de uranio, bajo la acción de la luz solar y de la radiación ultravioleta.
0,625 mPascal a 25 ºC.
3.751,7 kJ/mol a 25 ºC.
30,46 kJ/mol a 25 ºC.
26,26 mN/m.
Puede polimerizar bajo ciertas condiciones.
0,6 mg/m3.
1,4465 a 20 ºC.
7-8 a 20ºC.
El ciclohexeno no es muy estable durante un almacenamiento de larga duración. Una exposición a la luz y al aire puede provocar la producción de peróxidos. Asimismo, es incompatible con agentes oxidantes fuertes.
-Los cicloalquenos experimentan principalmente reacciones de adición, tanto electrofílicas como con radicales libres.
-Reacciona con el bromo para formar 1,2-dibromociclohexano.
-Se oxida rápidamente en presencia de permanganato de potasio (KMnO4).
-Es capaz de producir un epóxido (óxido de ciclohexeno) en presencia del ácido peroxibenzoico.
El ciclohexeno se produce mediante catálisis ácida del ciclohexanol:
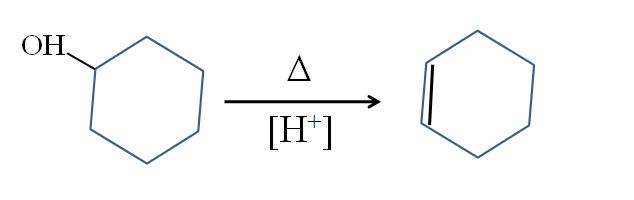
El símbolo Δ representa el calor necesario para promover la salida del grupo OH como molécula de agua en medio ácido (-OH2+).
También se produce ciclohexeno mediante la hidrogenación parcial del benceno; es decir, dos de sus dobles enlaces adicionan una molécula de hidrógeno:
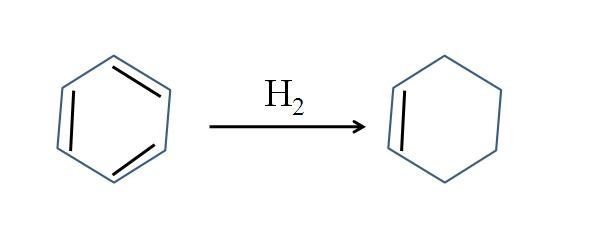
Aunque parezca simple la reacción, requiere de grandes presiones de H2 y catalizadores.
-Tiene utilidad como solvente orgánico. Además, es una materia prima para la producción de ácido adípico, aldehído adípico, ácido maleico, ciclohexano y ácido ciclohexilcarboxílico.
-Se emplea en la producción de cloruro de ciclohexano, compuesto utilizado como intermediario de la elaboración de productos farmacéuticos y aditivo de cauchos.
-También se usa el ciclohexeno en la síntesis de la ciclohexanona, materia prima para la producción de medicamentos, pesticidas, perfumes y tintes.
-El ciclohexeno interviene en la síntesis del aminociclohexanol, compuesto que se emplea como surfactante y emulsificante.
-Además, puede ser utilizado el ciclohexeno para la preparación en el laboratorio del butadieno. Este último compuesto se utiliza en la fabricación del caucho sintético, en la elaboración de neumáticos para automóviles, y también se usa en la elaboración de plásticos acrílicos.
-El ciclohexeno es materia prima para la síntesis de lisina, fenol, resina policicloolefina, y aditivos de caucho.
-Se usa como estabilizador de las gasolinas de alto octanaje.
-Interviene en la síntesis de recubrimientos impermeables, películas resistentes a las grietas, y carpetas de unión para revestimientos.
El ciclohexeno no es un compuesto muy tóxico, pero puede provocar por contacto un enrojecimiento de la piel y de los ojos. Su inhalación puede producir tos y somnolencia. Además, su ingestión puede producir somnolencia, dificultad para respirar y náuseas.
El ciclohexeno es poco absorbido en el tracto gastrointestinal, por lo que no se espera efectos sistémicos graves por su ingestión. La máxima complicación es su aspiración por el sistema respiratorio, el cual puede producir una neumonía química.
- Joseph F. Chiang, and Simon Harvey Bauer. (1968). Molecular structure of cyclohexene. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexene: Hazards, Synthesis & Structure. Study. Recuperado de: study.com
- Morrison, R. T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición.). Editorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyclohexene. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Chemical Book. (2019). Cyclohexene. Recuperado de: chemicalbook.com
- Toxicology Data Network. (2017). Cyclohexene. Toxnet. Recuperado de: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). The structural formula for cyclohexene is. Recuperado de: chemoxy.com
