Hibridación química: qué es, sp, sp2, sp3 (con ejemplos)
¿Qué es la hibridación química?
La hibridación química es la “mezcla” de los orbitales atómicos, cuyo concepto fue introducido por el químico Linus Pauling en 1931 para cubrir las imperfecciones de la Teoría del Enlace de Valencia (TEV). ¿Cuáles imperfecciones? Estas son: las geometrías moleculares y las longitudes de enlaces equivalentes en moléculas como el metano (CH4).
Según la TEV, en el metano los orbitales atómicos del C forman cuatro enlaces σ con cuatro átomos de H. Los orbitales 2p, con formas de ∞ (imagen inferior) del C son perpendiculares entre sí, por lo que los H deberían estar apartados unos de otros en un ángulo de 90º.
Adicionalmente, el orbital 2s (esférico) del C se enlaza al orbital 1s del H en un ángulo de 135º respecto a los otros tres H. Sin embargo, experimentalmente se ha encontrado que los ángulos en el CH4 son de 109,5º y que, además, las longitudes de los enlaces C–H son equivalentes.
Para explicar esto debe considerarse una combinación de los orbitales atómicos originales para formar cuatro orbitales híbridos degenerados (de igual energía). Aquí entra en juego la hibridación química. ¿Cómo son los orbitales híbridos? Depende de los orbitales atómicos que los generan. Asimismo, exhiben una mezcla de las características electrónicas de estos.
Hibridación sp3
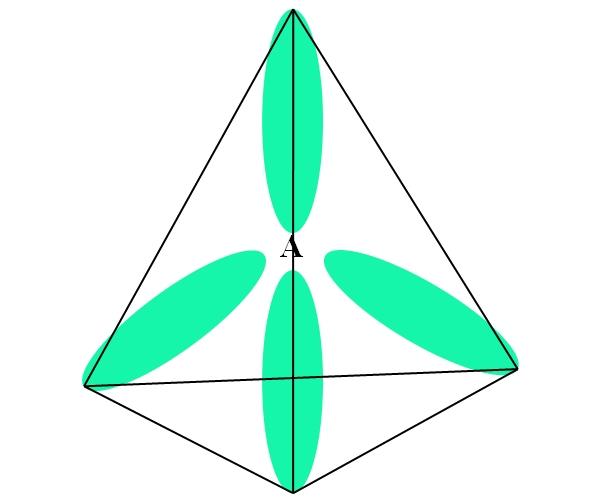
Para el caso del CH4, la hibridación del C es sp3. Desde este enfoque, la geometría molecular queda explicada con cuatro orbitales sp3 separados a 109,5º y apuntando hacia los vértices de un tetraedro.
En la imagen superior puede apreciarse cómo los orbitales sp3 (de color verde) establecen un entorno electrónico tetraédrico alrededor del átomo (A, el cual es C para el CH4).
¿Por qué 109,5º y no otros ángulos, para así “trazar” una geometría distinta? La razón se debe a que este ángulo disminuye al mínimo las repulsiones electrónicas de los cuatro átomos que se enlazan a A.
De este modo, la molécula de CH4 puede representarse como un tetraedro (geometría molecular tetraédrica).
Si, en lugar del H, el C formara enlaces con otros grupos de átomos, ¿cuál sería entonces su hibridación? Siempre que el carbono forme cuatro enlaces σ (C–A), su hibridación será sp3.
Se puede suponer consecuentemente que en otros compuestos orgánicos como CH3OH, CCl4, C(CH3)4, C6H12 (ciclohexano), etc., el carbono tiene una hibridación sp3.
Esto es fundamental para bosquejar estructuras orgánicas, donde los carbonos con enlaces simples representan puntos de divergencia; esto es, la estructura no permanece en un solo plano.
Interpretación
¿Cuál es la interpretación más simple para estos orbitales híbridos sin abordar los aspectos matemáticos (las funciones de onda)? Los orbitales sp3 implican que fueron originados por cuatro orbitales: uno s y tres p.
Debido a que la combinación de estos orbitales atómicos se supone que es ideal, los cuatro orbitales sp3 resultantes son idénticos y ocupan orientaciones diferentes en el espacio (tales como en los orbitales px, py y pz).
Lo anterior es aplicable para el resto de las hibridaciones posibles: el número de los orbitales híbridos que se forma es el mismo que el de los orbitales atómicos que se combinan. Por ejemplo, los orbitales híbridos sp3d2 se forman a partir de seis orbitales atómicos: un s, tres p y dos d.
Desviaciones de los ángulos de enlaces
De acuerdo con la Teoría de Repulsión de los Pares Electrónicos de la Capa de Valencia (RPECV), un par de electrones libres ocupa más volumen que un átomo enlazado. Esto ocasiona que los enlaces se aparten, disminuyendo la tensión electrónica y desviando los ángulos de los 109,5º:
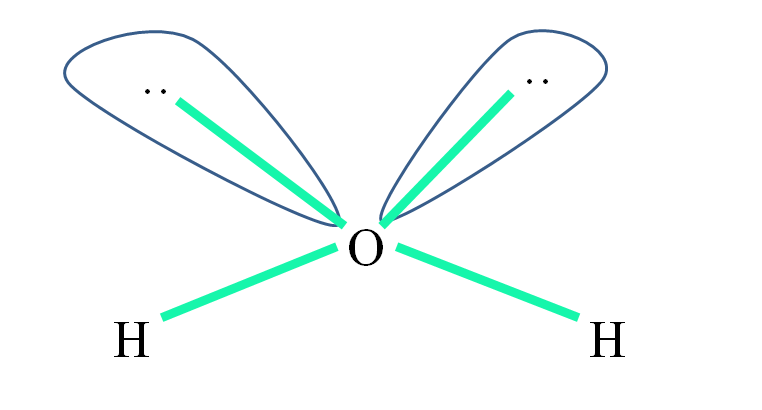
Por ejemplo, en la molécula de agua los átomos de H están enlazados a los orbitales sp3 (en verde), y asimismo los pares de electrones no compartidos “:” ocupan estos orbitales.
Las repulsiones de estos pares de electrones suele representarse como “dos globos con ojos”, los cuales, debido a su volumen, repelen a los dos enlaces σ O–H.
Así, en el agua los ángulos de enlaces son realmente 105º, en lugar de los 109,5º esperados para la geometría tetraédrica.
¿Qué geometría tiene entonces el H2O? Tiene una geometría angular. ¿Por qué? Porque si bien la geometría electrónica es tetraédrica, dos pares de electrones no compartidos la desvirtúan a una geometría molecular angular.
Hibridación sp2
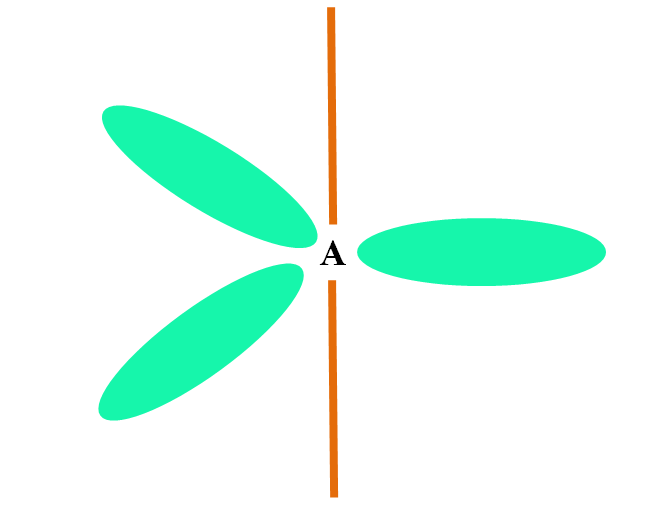
Cuando un átomo combina dos orbitales p y uno s, genera tres orbitales híbridos sp2; sin embargo, permanece inalterado un orbital p (porque son tres), el cual se representa como una barra naranja en la imagen superior.
Aquí, los tres orbitales sp2 están de color verde para resaltar su diferencia de la barra naranja: el orbital p “puro”.
Un átomo con hibridación sp2 puede visualizarse como un piso plano trigonal (el triángulo dibujado con los orbitales sp2 de color verde), con sus vértices separados por ángulos de 120º y perpendicular a una barra.
¿Y qué papel desempeña el orbital p puro? El de formar un enlace doble (=). Los orbitales sp2 permiten la formación de tres enlaces σ, mientras que el orbital p puro un enlace π (un doble o triple enlace implican uno o dos enlaces π).
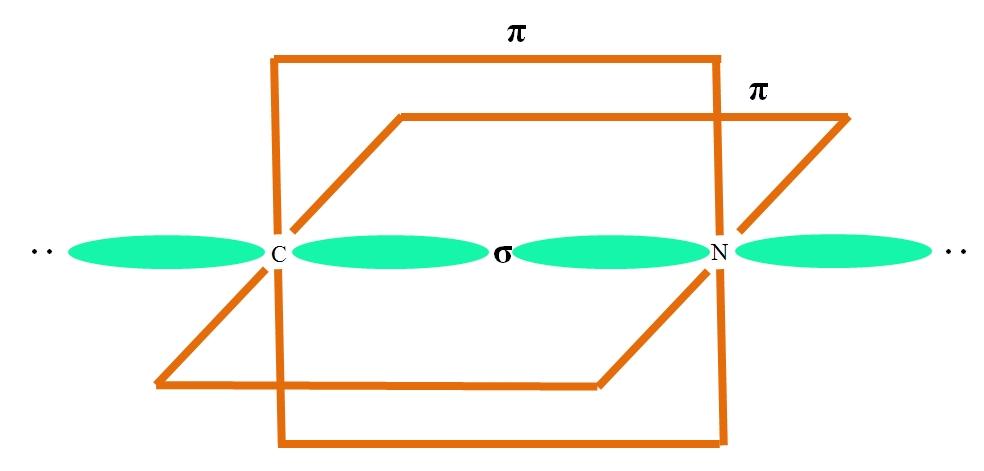
Por ejemplo, para dibujar el grupo carbonilo y la estructura de la molécula de formaldehído (H2C=O), se prosigue del siguiente modo:
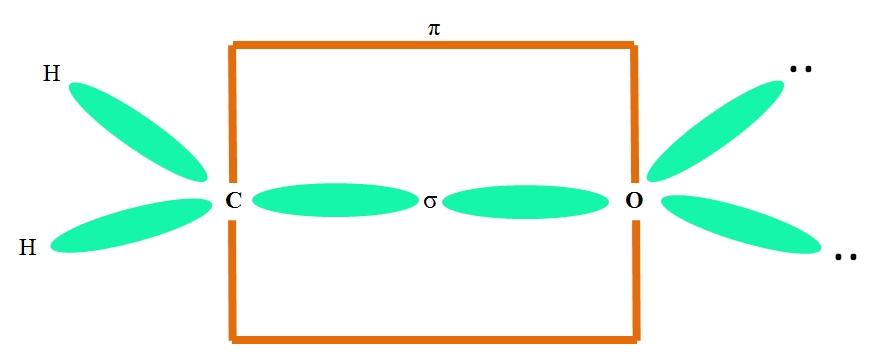
Los orbitales sp2 tanto del C como del O forman un enlace σ, mientras que sus orbitales puros forman un enlace π (el rectángulo naranja).
Puede notarse cómo el resto de los grupos electrónicos (átomos de H y los pares de electrones no compartidos) se sitúa en los otros orbitales sp2, separados por 120º.
Hibridación sp
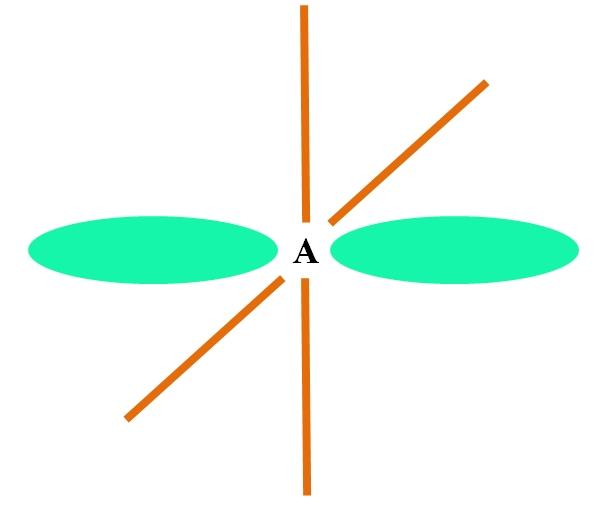
En la imagen superior se ilustra un átomo A con hibridación sp. Aquí, un orbital s y un orbital p se combinan para originar dos orbitales sp degenerados. Sin embargo, ahora quedan inalterados dos orbitales p puros, los cuales le permiten a A formar dos dobles enlaces o un triple enlace (≡).
En otras palabras: si en una estructura un C cumple con lo anterior (=C= o C≡C), entonces su hibridación es sp. Para otros átomos menos ilustrativos —como los metales de transición— la descripción de las geometrías electrónicas y moleculares se complica porque también se consideran los orbitales d y hasta los f.
Los orbitales híbridos están separados en un ángulo de 180º. Por esta razón los átomos enlazados se disponen en una geometría molecular lineal (B-A-B). Finalmente, en la imagen inferior puede apreciarse la estructura del anión cianuro: