Hexoquinasa: estructuras, funciones, formas
La hexoquinasa (HK) es la enzima que cataliza la primera reacción de la ruta glucolítica virtualmente en todos los organismos vivos, tanto en procariotas como en eucariotas. Se encarga de la transferencia de un grupo fosforilo hacia la glucosa, produciendo glucosa-6P, aunque también puede fosforilar otros azúcares hexosas (de 6 átomos de carbono).
Esta enzima se clasifica dentro de una de las dos familias de enzimas glucosas quinasas (enzimas que transfieren grupos fosforilo a sustratos como la glucosa): la familia hexoquinasa (HK), cuyos miembros se subdividen en tres grupos diferentes conocidos como el grupo HK, el grupo A y el grupo B.

Las enzimas pertenecientes a la familia HK se caracterizan por fosforilar glucosa a expensas de ATP como molécula donadora de grupo fosforilo, y los integrantes de la misma difieren entre sí principalmente respecto a su peso molecular y especificidad de sustrato.
Al grupo HK pertenecen las enzimas de los organismos eucariotas (ATP: D-hexosa 6-fosfotransferasas), entretanto el grupo A está representado por las enzimas de las bacterias gramnegativas, cianobacterias, protistas amitocondriados y tripanosomátidos, y el grupo B contiene a las enzimas de las bacterias grampositivas y de los organismos crenarqueotas.
Las enzimas de los grupos A y B se conocen también como glucoquinasas (GlcKs), pues son capaces de fosforilar exclusivamente glucosa, razón por la cual estas enzimas se denominan ATP: D-glucosa 6-fosfotransferasas.
Como enzima glucolítica, la hexoquinasa tiene gran importancia metabólica, pues sin ella esta importante ruta no sería posible y las células altamente dependientes del consumo de carbohidratos como, por ejemplo, las células cerebrales y musculares de muchos mamíferos, tendrían serios impedimentos funcionales y fisiológicos en general.
Índice del artículo
Como se verá más adelante, en los mamíferos y otros vertebrados (así como en organismos unicelulares como las levaduras) existen diferentes tipos de enzimas hexoquinasas. En los mamíferos se han descrito cuatro: las isoformas I, II, III y IV.
Las primeras tres isoenzimas tienen 100 kDa de peso molecular, pero la isoenzima IV tiene 50 kDa. Estas isoenzimas (especialmente I-III) exhiben alta similitud de secuencia entre ellas respecto a sus extremos C- y N-terminales, así como con otros miembros de la familia hexoquinasa.
El dominio N-terminal de estas enzimas se considera el dominio “regulador”, mientras que la actividad catalítica es llevada a cabo por el dominio C-terminal (la HK II de los mamíferos tiene sitios activos en ambos dominios).
El dominio N-terminal está unido al dominio C-terminal a través de una hélice alfa, cada uno tiene más o menos 50 kDa de peso molecular y posee un sitio de unión para la glucosa.
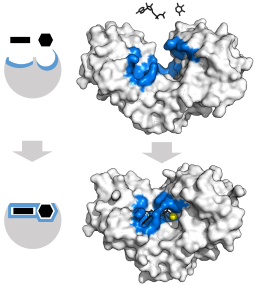
La estructura terciaria de estas enzimas está compuesta esencialmente por láminas β-plegadas mezcladas con hélices alfa, cuya proporción varía respecto a la enzima y a la especie en cuestión; el sitio de unión para el ATP, el otro sustrato de la hexoquinasa, está compuesto usualmente de cinco láminas β y dos hélices alfa.
La hexoquinasa tiene una función trascendental en el metabolismo de carbohidratos de la mayor parte de los seres vivos, puesto que cataliza el primer paso de la ruta glucolítica, mediando la fosforilación de la glucosa en el interior celular.
Este primer paso de la glicólisis, que consiste en la transferencia de un grupo fosforilo desde el ATP (donador) hacia la glucosa, rindiendo glucosa 6-fosfato y ADP, es el primero de los dos pasos de inversión de energía en forma de ATP.
Además, la reacción catalizada por la hexoquinasa es el paso de “activación” de la glucosa para su procesamiento posterior y representa un paso de “compromiso”, pues la glucosa así fosforilada no puede abandonar la célula por medio de sus transportadores convencionales en la membrana plasmática.
El producto de la reacción catalizada por la hexoquinasa, es decir, la glucosa 6-fosfato, es un punto de ramificación, pues es el primer sustrato empleado en la ruta de las pentosas fosfato y en la síntesis de glucógeno en muchos animales (y del almidón en las plantas).
La función de la hexoquinasa en las plantas no es muy diferente a la de los animales o los microorganismos, sin embargo, en las plantas superiores esta enzima también funciona como “sensor” de la concentración de azúcares.
La importancia de esta función en estos organismos tiene que ver con la participación de los azúcares como factores de regulación en la expresión de los genes que están implicados en diferentes procesos metabólicos como:
– La fotosíntesis
– El ciclo del glioxilato
– La respiración
– La degradación o síntesis de almidón y sacarosa
– El metabolismo del nitrógeno
– La defensa frente a patógenos
– La regulación del ciclo celular
– La respuesta de cicatrización
– La pigmentación
– La senescencia, entre otros.
Esta función de la hexoquinasa como “sensor” de la cantidad de la cantidad de glucosa intracelular también ha sido descrita para las levaduras y los mamíferos.
En la naturaleza existen diferentes formas de hexoquinasas y esto depende fundamentalmente de la especie que se considere.
En el hombre y otros animales vertebrados, por ejemplo, se ha demostrado la existencia de 4 isoformas diferentes de la enzima hexoquinasa en el compartimento citosólico, a las cuales se ha denotado con los números romanos I, II, III y IV.
Las isoenzimas I, II y III tienen 100 kDa de peso molecular, son inhibidas por su producto de reacción (glucosa 6-fosfato) y son muy afines a la glucosa, es decir, tienen una constante Km muy baja. Sin embargo, estas enzimas tienen poca especificidad de sustrato, pudiendo fosforilar otras hexosas como la fructosa y la manosa.
La isoenzima IV, también conocida como glucoquinasa (GlcK), tiene solo 50 kDa de peso molecular y, a pesar de ser poco afín (altos valores de Km), tiene una elevada especificidad por la glucosa como sustrato y no está sometida a los mismos mecanismos de regulación que las otras tres isoenzimas.
La glucoquinasa (isoenzima IV de la hexoquinasa de muchos mamíferos) se encuentra principalmente en el hígado y ayuda a este órgano en el “ajuste” de su velocidad de consumo de glucosa en respuesta a las variaciones de este sustrato en la sangre circulante.
Los tres genes que codifican para las hexoquinasas I, II y III en los animales parecen tener un mismo ancestro de 50 kDa que se duplicó y se fusionó en el genoma, lo que parece evidente cuando se observa que la actividad catalítica de las formas I y III reside únicamente en el extremo C-terminal.
- Aronoff, S. L., Berkowitz, K., Shreiner, B., & Want, L. (2004). Glucose metabolism and regulation: beyond insulin and glucagon. Diabetes spectrum, 17(3), 183-190.
- Harrington, G. N., & Bush, D. R. (2003). The bifunctional role of hexokinase in metabolism and glucose signaling. The Plant Cell, 15(11), 2493-2496.
- Jang, J. C., León, P., Zhou, L., & Sheen, J. (1997). Hexokinase as a sugar sensor in higher plants. The Plant Cell, 9(1), 5-19.
- Kawai, S., Mukai, T., Mori, S., Mikami, B., & Murata, K. (2005). Hypothesis: structures, evolution, and ancestor of glucose kinases in the hexokinase family. Journal of Bioscience and Bioengineering, 99(4), 320–330.
- Mathews, K. E. (1998). Van Holde. Biochemistry.
- Wilson, J. E. (2003). Isozymes of mammalian hexokinase: structure, subcellular localization and metabolic function. Journal of Experimental Biology, 206(12), 2049-2057.
