Oxalato de sodio (Na2C2O4): estructura, propiedades, usos, riesgos
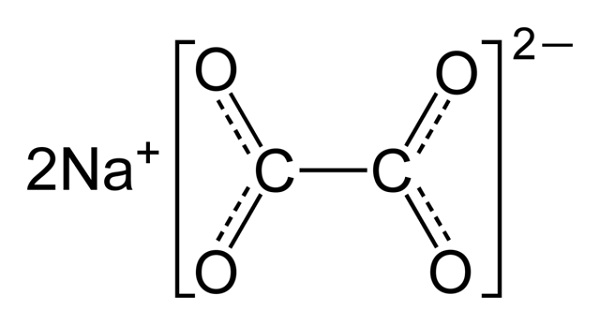
El oxalato de sodio es un compuesto orgánico formado por dos iones sodio y un ion oxalato. Su fórmula química es Na2C2O4 o también Na2(COO)2. Es la sal sódica del ácido oxálico o ácido etanodioico. El Na2C2O4 es un sólido blanco cristalino y sus soluciones acuosas son básicas (alcalinas).
El oxalato de sodio está presente en plantas y vegetales. En el ser humano se genera de forma natural a partir de su ácido conjugado el ácido oxálico, que a su vez se produce por ciertos procesos metabólicos.

El Na2C2O4 es utilizado en los laboratorios de análisis químicos como agente reductor (lo contrario de oxidante). También para permitir pruebas a ciertos compuestos orgánicos durante el tratamiento de aguas de desecho.
Ha sido empleado para la eliminación de desechos de clorofluorocarbonos (CGC), los cuales dañan la capa de ozono. Además es materia prima para obtener ácido oxálico de forma económica.
Debido al alto contenido de oxalato de sodio de algunos vegetales comestibles, las personas que tienen tendencia a formar cálculos o piedras en los riñones deben evitar consumir tales alimentos. Esto se debe a que las piedras generalmente se forman con oxalatos.
Índice del artículo
El oxalato de sodio está formado por dos cationes sodio Na+ y un anión oxalato (COO)22–. El anión oxalato está formado a su vez por dos unidades COO– unidas a través de los dos átomos de carbono: –OOC–COO–.
En el oxalato de sodio sólido, el anión oxalato tiene una forma plana. Esto significa que tanto los carbonos como los oxígenos se encuentran en un mismo plano.
– Oxalato de sodio
– Oxalato de disodio
– Sal sódica del ácido etanodioico
Sólido blanco cristalino.
134,0 g/mol
2,27 g/cm3 a 20 °C.
Soluble en agua: 3,7 g/100 mL a 20 °C.
Sus soluciones acuosas son básicas (alcalinas) debido a que el anión oxalato tiende a tomar protones del agua dejando libres los iones OH–.
Puede neutralizar ácidos y las reacciones son exotérmicas, esto es, desprenden calor.
Sirve como agente reductor y en estas reacciones genera dióxido de carbono CO2.
Tiene la propiedad de unirse fuertemente a varios iones metálicos como por ejemplo los iones de hierro ferroso Fe2+ y férrico Fe3+.
De acuerdo con una fuente consultada el oxalato de sodio se puede obtener oxidando carbón con oxígeno O2 a una temperatura de unos 250 °C en una solución concentrada de hidróxido de sodio NaOH.
El oxalato de sodio se encuentra presente en muchas plantas y vegetales, como por ejemplo la acelga, la espinaca y el ruibarbo, y en granos como la soya, entre muchos otros productos vegetales.

Su ácido conjugado el ácido oxálico se produce en el organismo humano por el metabolismo del ácido glicólico o del ácido ascórbico. Una vez producido no se metaboliza, sino que se excreta por la orina en forma de oxalato.

Se emplea como reactivo químico, generalmente como agente reductor, por ejemplo para la estandarización de soluciones de permanganato de potasio, es decir, para determinar con exactitud cuánto permanganato de sodio tienen.
El oxalato de sodio ha sido usado para la destrucción de clorofluorocarbonos (CFC). Estos compuestos CFC han sido unos de los responsables de la destrucción de la capa de ozono del planeta (la cual nos protege de la radiación ultravioleta).
En 1996, algunos investigadores propusieron la utilización del oxalato de sodio para eliminarlos, pues este reacciona fácilmente con los CFC a temperaturas de 270-290 °C, convirtiéndolos en productos inocuos hacia la capa de ozono.
La reacción del oxalato de sodio con los CFC puede ser controlada para obtener hidrocarburos aromáticos halogenados que no son dañinos para la capa de ozono pero que son compuestos útiles en la industria química.
Dicha reacción también puede ser llevada al máximo y convertir todo el CFC en fluoruro de sodio NaF, cloruro de sodio NaCl, carbono elemental y dióxido de carbono CO2.

Se ha encontrado que el oxalato de sodio es útil para medir la cantidad y clases de compuestos orgánicos que secretan los microorganismos de los lodos que se usan para tratar aguas de desecho.
La medida de tales compuestos es importante para determinar su función durante el tratamiento del agua residual, pues de los mismos depende la facilidad de separar el lodo del agua.
Utilizando oxalato de sodio se evitan los inconvenientes de otros métodos.
El oxalato de sodio crudo procedente de desechos de ciertos procesos se ha utilizado para producir ácido oxálico H2C2O4 en grandes cantidades.
El método utiliza los lodos procedentes del proceso Bayer para tratar bauxita (un mineral de aluminio). En el proceso Bayer se trata la bauxita con hidróxido de sodio NaOH para disolver la alúmina de este mineral.
En el proceso de disolución de la alúmina ciertos compuestos orgánicos presentes en el mineral como los ácidos húmicos son atacados por el NaOH, generando gran cantidad de oxalato de sodio Na2C2O4.
Este oxalato de sodio está incorporado a un lodo con compuestos de aluminio. Para purificarlo se disuelve el conjunto, se filtra y se pasa a través de una columna de intercambio iónico de tipo ácido.
En la columna se encuentra una resina de ácido sulfónico RSO3H donde se intercambian iones metálicos Na+ por iones hidrógeno H+, por lo que se obtiene el ácido oxálico H2C2O4.
RSO3H + Na2C2O4 ⇔ RSO3Na + NaHC2O4
RSO3H + NaHC2O4 ⇔ RSO3Na + H2C2O4
Este es un proceso económico y el ácido oxálico obtenido es de una pureza aceptable.
El ácido conjugado del oxalato de sodio, el ácido oxálico H2C2O4, se emplea para disolver ciertos tipos de desechos e incrustaciones.
Se aprovecha la característica del ácido oxálico de convertirse en oxalato actuando como agente acomplejante o precipitante por ejemplo durante el procesamiento de desechos de varios combustibles nucleares.
El ácido oxálico se usa además para remover las incrustaciones de minerales y óxidos de hierro en tuberías y otros equipos, esto se debe a su habilidad para unirse fuertemente tanto al ión ferroso Fe2+ como al ion férrico Fe3+ formando oxalatos.
Si se inhala o ingiere directamente el oxalato de sodio causa dolor en la garganta, esófago y estómago. Produce vómitos, purga severa, pulso débil, colapso cardiovascular, síntomas neuromusculares y daño en los riñones.
Las personas que tienen tendencia a formar cálculos en los riñones por acumulación de oxalato en la orina deben evitar consumir vegetales con alto contenido de oxalatos solubles como el de sodio.
El oxalato de sodio en altas cantidades en los alimentos al llegar a la orina se une al calcio presente en esta y puede producir cálculos o piedras de oxalato de calcio en los riñones a las personas que tienen tendencia a ello.
- U.S. National Library of Medicine. (2019). Sodium oxalate. National Center for Biotechnology Information. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Chai, W. and Liebman, M. (2005). Effect of Different Cooking Methods on Vegetable Oxalate Content. J. Agric. Food Chem. 2005, 53, 3027-3030. Recuperado de pubs.acs.org.
- Dagani, R. (1996). CFC Destroying Reaction. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Recuperado de pubs.acs.org.
- Sajjad, M. and Kim, K.S. (2016). Extraction of extracellular polymeric substances from activated sludge using sodium oxalate. Int. J. Environ. Sci. Technol. 13, 1697-1706 (2016). Recuperado de link.springer.com.
- Jeffrey, G.A. and Parry, G.S. (1954). The Crystal Structure of Sodium Oxalate. J. Am. Chem. Soc. 1954, 76, 21, 5283-5286. Recuperado de pubs.acs.org.
- Okuwaki, A. et al. (1984). Production of Oxalate by the Oxidation of Coal with Oxygen in a Concentrated Sodium Hydroxide Solution. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Recuperado de pubs.acs.org.
- Hefter, G. et al. (2018). Solubility of Sodium Oxalate in Concentrated Electrolyte Solutions. J Chem & Eng Data. 2018, 63, 3, 542-552. Recuperado de pubs.acs.org.
- The, K. I. (1992). Process for the preparation of oxalic acid and sodium hydrogen oxalate from crude sodium oxalate. U.S. Patent N°5,171,887. Dec.15, 1992. Recuperado de freepatentsonline.com.
