Beta galactosidasa: características, estructura, funciones
La Beta galactosidasa, denominada también β-galactosidasa o β-D-galactohidrolasa es una enzima perteneciente a la familia de las glicosil hidrolasas capaz de hidrolizar los residuos galactosil de distintas clases de moléculas: polímeros, oligosacáridos y metabolitos secundarios, entre otros.
Conocida anteriormente como “lactasa”, su distribución, así como la de los oligo- y polisacáridos β-galactosidados que le sirven de sustrato, es sumamente amplia. Se encuentra en bacterias, hongos y levaduras; en las plantas es común en almendras, duraznos, albaricoques y manzanas, y en los animales está presente en órganos como el estómago y los intestinos.
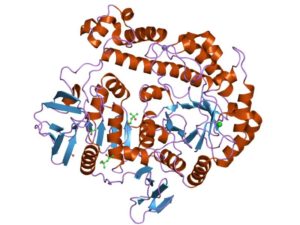
La enzima más estudiada es la del operón Lac de E. coli, codificada por el gen lacZ, cuyos estudios han sido claves para la comprensión del funcionamiento de los operones genéticos y de muchos aspectos regulatorios de los mismos.
Actualmente pertenece al grupo de las enzimas mejor estudiadas y su función más conocida es la de la hidrólisis de los enlaces glucosídicos de la lactosa. Cumple funciones metabólicas esenciales en los organismos que la expresan y también es empleada con distintos propósitos industriales.
Entre las aplicaciones industriales están la remoción de la lactosa de los productos lácteos para las personas intolerantes a la lactosa y la producción de varios compuestos galactosidados. También son empleadas para mejorar la dulzura, el sabor y la digestión de muchos productos lácteos.
Índice del artículo
Además de los sustratos galactosidados como la lactosa, la mayor parte de las β-galactosidasas conocidas requieren iones metálicos divalentes como el magnesio y el sodio. Ello ha sido comprobado con el hallazgo de los sitios de unión para dichos metales en su estructura.
Las β-galactosidasas presentes en la naturaleza tienen gran variedad de rangos de pH a los que pueden trabajar. Las enzimas fúngicas funcionan en ambientes ácidos (de 2.5 a 5.4), mientras que las de levaduras y bacterias trabajan entre las 6 y 7 unidades de pH.
Las bacterias poseen enzimas galacto-hidrolíticas de gran tamaño en comparación con otras de las galactosidasas analizadas. En estos organismos, la misma enzima cataliza tres tipos reacciones enzimáticas:
– Hidroliza lactosa a sus monosacáridos constitutivos: galactosa y glucosa.
– Cataliza la transgalactosilación de la lactosa a la alolactosa, un azúcar disacárido que participa en la regulación positiva de la expresión de los genes pertenecientes al operón Lac, eç.
– Hidroliza la alolactosa de forma similar a como lo hace con la lactosa.
Los hongos poseen enzimas β-galactosidasas más susceptibles a la inhibición por galactosa que las enzimas pertenecientes a otros organismos. No obstante, estas son termoestables y trabajan en rangos de pH ácidos.
El metabolismo de la lactosa mediada por estas enzimas en los hongos se divide en extracelular y citosólico, ya que estos organismos pueden emplear la β-galactosidasa para hidrolizar lactosa extracelularmente e introducir los productos hacia las células o pueden tomar directamente el disacárido y procesarlo internamente.
La enzima β-galactosidasa de bacterias es una enzima tetramérica (de cuatro subunidades idénticas, A-D) y cada uno de sus monómeros tiene más de 1.000 residuos aminoacídicos, lo que significa un peso molecular de más de 100 kDa para cada uno y más de 400 kDa para la proteína acomplejada.
En las plantas, por el contrario, la enzima es de un tamaño considerablemente menor y puede hallarse comúnmente como un dímero de subunidades idénticas.
Los dominios de cada monómero se distinguen con los números del 1 al 5. El dominio 3 tiene una estructura de barril α/β “TIM” y posee el sitio activo en el extremo C-terminal del barril.
Se presume que los sitios activos del complejo enzimático se comparten entre monómeros, por lo que esta enzima es biológicamente activa únicamente cuando se encuentra acomplejada como tetrámero.
Su sitio activo tiene la capacidad de unirse a D-glucosa y D-galactosa, los dos monosacáridos que conforman la lactosa. Es particularmente específico para la D-galactosa, pero no lo es tanto para la glucosa, por lo que la enzima puede actuar sobre otros galactósidos.
En el intestino de los humanos, la función principal de esta enzima tiene que ver con la absorción de la lactosa ingerida con los alimentos, pues se localiza en la cara luminal de la membrana plasmática de las células intestinales en forma de cepillo.
Además, se ha demostrado que las isoformas lisosomales de esta enzima participan en la degradación de muchos glucolípidos, mucopolisacáridos y glicoproteínas galactosidadas, lo que tiene múltiples propósitos en diferentes rutas celulares.
Las plantas poseen enzimas β-galactosidasas en las hojas y las semillas. Estas cumplen funciones importantes en el catabolismo de los galactolípidos, que son característicos de algas y plantas en general.
En estos organismos, la β-galactosidasa participa en los procesos de crecimiento vegetal, maduración de las frutas y, en las plantas superiores, esta es la única enzima conocida capaz de hidrolizar residuos galactosil a partir de los polisacáridos galacosidados de la pared celular.
En la industria alimenticia relacionada con productos lácteos, la enzima β-galactosidasa es empleada para catalizar la hidrólisis de la lactosa presente en los lácteos, que es responsable de muchos de los defectos relativos al almacenamiento de estos productos.
La hidrólisis de este azúcar busca evitar la sedimentación de partículas, la cristalización de los postres lácteos congelados y la presencia de texturas “arenosas” en la mayor parte de los derivados comerciales de la leche.
La β-galactosidasa que se emplea industrialmente se obtiene, comúnmente, a partir del hongo Aspergillus sp., aunque la enzima producida por la levadura Kluyveromyces lactis también es muy utilizada.
La actividad β-galactosidasa, que se traduce en términos científicos como “fermentación de la lactosa”, es ensayada rutinariamente para la identificación de enterobacterias gram negativas presentes en distintos tipos de muestras.
Además, en términos médicos, es empleada para la producción de lácteos libres de lactosa y para la formulación de tabletas que emplean las personas intolerantes a la lactosa para poder digerir leche y sus derivados (yogurt, queso, helado, mantequilla, cremas, etc).
Es empleada como “biosensor” o “biomarcador” con diversidad de propósitos, desde inmunoensayos y análisis toxicológicos hasta análisis de la expresión génica y diagnóstico de patologías gracias a la inmovilización química de esta enzima en soportes especiales.
- Henrissat, B., & Daviest, G. (1997). Structural and sequence-based classification of glycoside hydrolases. Current Biology, 7, 637–644.
- Huber, R. (2001). Beta (B)-Galactosidase. Academic Press, 212–214.
- Husain, Q. (2010). β Galactosidases and their potential applications: a review. Critical Reviews in Biotechnology, 30, 41–62.
- Juers, D. H., Matthews, B. W., & Huber, R. E. (2012). LacZ B-galactosidase: Structure and function of an enzyme of historical and molecular biological importance. Protein Science, 21, 1792–1807.
- Lee, B. Y., Han, J. A., Im, J. S., Morrone, A., Johung, K., Goodwin, C., … Hwang, E. S. (2006). Senescence-associated β -galactosidase is lysosomal β -galactosidase. Aging Cell, 5, 187–195.
- Matthews, B. W. (2005). The structure of E. coli β-galactosidase. C. R. Biologies, 328, 549–556.
- Mccarter, J. D., & Withers, S. G. (1994). Mechanisms of enzymatic glycoside hydrolysis. Current Opinion in Structural Biology, 4, 885–892.
- Richmond, M., Gray, J., & Stine, C. (1981). Beta-Galactosidase: Review of Recent Research Related to Technological Application, Nutritional Concerns, and Immobilization. J Dairy Sci, 64, 1759–1771.
- Wallenfels, K., & Weil, R. (1972). B-Galactosidase.
