Molaridad: concentración, unidades, cálculo, ejercicios
La molaridad es la concentración de una solución expresada en moles del soluto por litro de solución. Es abreviada como M y expresa una relación entre la masa del soluto y el volumen de la solución (m/v); aunque en forma tradicional esta relación es expresada como peso a volumen.
Un mol es el número de átomos o moléculas contenidos en el peso atómico o molecular; se expresa en gramos/mol. Un mol equivale a 6,02·1023 átomos o moléculas, conocido como el número de Avogadro.
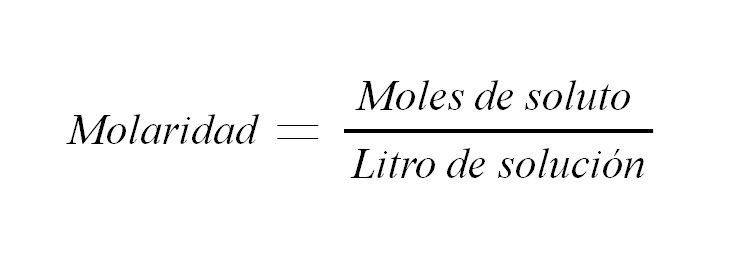
Existen otras formas de expresar la relación entre la masa de un soluto y el volumen, entre ellas: la relación porcentual entre la masa del soluto y el volumen de la solución, y la normalidad. Esta última se expresa como el número de equivalentes de un soluto por litro de solución.
Mientras, la molalidad, que se define como el número de moles por kilogramos de solvente, usualmente agua, expresa una relación entre la masa del soluto y la masa del solvente (m/m).
La forma de expresión de la concentración de una solución en partes por millón (ppm), expresa una relación entre una parte del soluto y un millón de partes de la solución, usándose generalmente para expresar una relación masa-masa (m/m). Pero puede expresar una relación masa-volumen (m/v).
La concentración molar, además de expresarse en moles por litro, puede expresarse como milimoles/litro (solución milimolar); micromoles/ litro (solución micromolar); etc.
Los problemas de molaridad pueden ser resueltos usando un método analítico y mediante el uso de “la regla de tres”. La elección de un método va a depender de la habilidad que se tenga en el uso de uno de los métodos.
Índice del artículo
- 1 Concentración molar
- 2 Unidades
- 3 ¿Cómo calcular la molaridad?
- 4 Pasar de la molaridad a la molalidad
- 5 Problemas resueltos
- 6 Referencias
Es utilizada para expresar la concentración de un soluto en un volumen determinado de solución.
M = n/V (1)
Donde M es igual a la molaridad, n es el número de moles, y V el volumen de la solución. Entonces, la molaridad de una solución es el número de moles de soluto por volumen de solución expresado en litros.
Por otro lado el número de moles es
n = m / PM (2)
Siendo m la masa del soluto disuelto y PM su masa molar.
Sustituyendo (2) en (1):
M = (m / PM) / V
La unidad en el Sistema Internacional para la concentración molar es mol/m3. Esto corresponde a una solución milimolar, porque un m3 equivale a 1.000 litros. En las ramas de la química y la biología se suele expresar la concentración molar como moles/L. Esta unidad se expresa con la M (mayúscula).
Una solución de un mol/L, equivale a una solución M; una solución de 10-3 moles/L, equivale a 1mM (milimolar); y una solución de 10-6 moles/L, equivale a 1µM (micromolar).
Es conveniente utilizar las expresiones señaladas anteriormente, porque esto asegura que el resultado de aplicar la fórmula dará en moles/litros, la cual es la definición de concentración molar.
Entonces, para calcular la molaridad de una solución es necesario expresar la concentración del soluto en g / L. Averiguar luego el peso molecular del soluto (g / mol) y hallar el cociente entre la concentración y el peso molecular. El resultado obtenido es la molaridad expresada en moles / litro.
Un dato necesario para pasar de la molaridad a la molalidad es conocer la densidad de la solución. Esto permite conocer la masa de la solución, requisito imprescindible para el cálculo de la molalidad.
Primero hay que pasar de la concentración molar a gramos/litros. Para ello basta con multiplicar la molaridad de la solución por el peso molecular del soluto.
Gramos/litro del soluto = molaridad (moles/litro) · peso molecular del soluto (gramos/mol).
Esto permite obtener la masa del soluto en 1 L de solución.
Después es necesario calcular la masa de la solución. Para ello, se utiliza la densidad de la misma. Usualmente la densidad se expresa en gramos/centímetro cúbico o mililitro.
Masa de la solución (g) = volumen de la solución (mL) · densidad (g/mL)
Obtención de la masa del solvente. Como la masa de la solución es igual a la masa del soluto más la masa del solvente, para obtener la masa del último basta con sustraer de la masa de la solución (paso 2) la masa del soluto (paso 1).
Por último hay que pasar la masa del soluto (g) de la solución a la masa de soluto que corresponde a 1.000 g o 1 kg de solvente. Para ello, bastaría con realizar una regla de tres sencilla u otra operación matemática equivalente.
Dividir g de soluto/1000 g de solvente entre peso molecular del soluto (g/mol) para obtener la molalidad de la solución.
Una solución 3 M de glucosa (peso molecular 180 g/mol) tiene una densidad de 1,15 g/mL. Calcular la molalidad de esta solución.
Calculamos primero los gramos de glucosa disueltos en un litro de disolución:
g/L = 3 moles/L · 180 g/mol
= 540 g/L
Luego, calculamos la masa de la solución a partir de su densidad:
g de la solución (masa) = 1.000 mL · 1,15 g/mL
= 1.150 g
La masa de solvente viene dada por la diferencia:
Masa del solvente = masa de la solución – masa del soluto
= 1.150 g – 540 g
= 610 g
Pero 610 g no son 1000 g de solvente como estipula la definición de molalidad. Por lo tanto, debe calcularse cuántos gramos de glucosa están disueltos en 1000 g de solvente:
Masa de soluto = 540 g soluto · (1.000 g solvente / 610 g de solvente)
= 885,25 g
Y finalmente se calcula la molalidad devolviendo los gramos a moles:
Molalidad = (885,25 g de soluto / 180 g/mol)
= 4,92 mol soluto / kg de solvente
= 4,92 m
¿Qué cantidad de sulfato cúprico será necesario para preparar 500 mL de una solución 0,4 M? Expresar el resultado en gramos. Peso molecular del sulfato cúprico (CuSO4): 160 g/mol.
Determinamos primero los moles que deben estar disueltos en tal solución:
M = n/ V
n = M · V
n = (0,4 moles/L) · 0,5 L
= 0,2 moles
Conociendo entonces el número de moles de sulfato cúprico se puede obtener su masa
n = m/PM
m = n · peso molecular
m = 0,2 moles · 160 g/mol
= 32 g de CuSO4
Es decir, que 32 gramos de esta sal deben disolverse en 500 mL de solvente.
¿Qué volumen de una solución se necesita para que al disolverse 0,4 moles de soluto esta tenga una concentración de 0,25 M?
El volumen de la solución se obtiene del concepto de molaridad
M = n / V
V = n / M
V = 0,4 moles / (0,25 moles / L)
= 1,6 L
Quiere decir que la solución debe tener un volumen de 1,6 litros para obtenerse tal concentración de 0,25 M.
Una masa de 8 g hidróxido de sodio (NaOH) se encuentra disuelta en 60 g de una solución que tiene una densidad de 1,6 g/mL. ¿Cuál será la molaridad de la solución? Peso molecular del hidróxido de sodio: 40 g/mol.
Deben calcularse primero los moles de NaOH:
n= m / PM
= 8 g hidróxido de sodio / (40 g/mol)
= 0,2 moles
Ahora se procede a calcular el volumen de la solución:
m = V · d
v = 60 g /(1,6 g/mL)
v = 37,5 mL
Para obtener la molaridad debe colocarse el volumen de la solución en litros:
V = 37,5 ml · 10-3 L / mL
= 0,0375 L
M = 0,2 moles / 0,0375 L
5,33 moles / L
5,33 M
Calcular la molaridad de una solución de ácido clorhídrico (HCl) con una densidad 1,25 g/mL y un 35% de concentración, expresada masa/masa. Peso molecular del ácido clorhídrico: 36,5 g/mol.
Se determina la masa de ácido clorhídrico al 35%
m = V · d
m = 1.000 mL · 1,25 g/mL
= 1.250 g
Pero no todo es HCl, sino que también hay agua:
masa HCl = 1.250 g · (35 /100)
= 437,5 g
Lo que es igual a decir que en un litro de solución de HCl al 35% hay 437,5 gramos de HCl.
Luego, se calculan los moles de HCl, para acto seguido determinar la molaridad:
n = m / PM
n = (437,5 g/L) / (36,5 g/mol)
= 11,98 moles/L
Molaridad = 11,98 M
Calcular la molaridad de una solución que contiene 5 g de NaCl en 2 L de solución. Peso molecular del cloruro de sodio: 58,5 g/mol.
Se pueden obtener los moles/L de NaCl en un solo paso:
molaridad = (5 g NaCl / 2 L solución) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 moles /L
Molaridad = 0,043 M
Otro procedimiento podría ser:
g / L de NaCl = 5 g / 2 L
= 2,5 g / L
moles / L = (2,5 g / L) / (58,5 g /mol)
= 0,043 moles / L
= 0,043 M
- Rodríguez, M. (2007). Química. Fundación Editorial Salesiana
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2019). Molaridad. Recuperado de: es.wikipedia.org
- Atarés Huerta. (s.f.). Molaridad y molalidad. [PDF]. Recuperado de: riunet.upv.es
- Softchools. (2019). Molarity formula. Recuperado de: softschools.com
