Catalasa: características, estructura, funciones, patologías
La catalasa es una enzima oxidorreductasa (H2O2: H2O2 oxidorreductasa) ampliamente distribuida en la naturaleza. Cataliza, en diversos tejidos y tipos de células, la reacción de “descomposición” del peróxido de hidrógeno en oxígeno molecular y agua.
Las primeras observaciones de este tipo de enzima se remontan a comienzos de la década de 1810, pero fue en 1901 cuando Loew reconoció que la catalasa está presente virtualmente en todos los organismos vivos existentes y en múltiples tipos de células diferentes.
Esta enzima, crucial para el mantenimiento de la integridad celular y principal regulador del metabolismo de peróxido de hidrógeno, fue un factor fundamental para poder afirmar que en la naturaleza existen enzimas que actúan sobre sustratos específicos.
Los mamíferos y otros organismos poseen enzimas catalasas que también pueden comportarse como peroxidasas, catalizando reacciones de oxidorreducción de diferentes sustratos utilizando al peróxido de hidrógeno.
En la mayor parte de los eucariotas las enzimas catalasas se encuentran preponderantemente en orgánulos subcelulares conocidos como “peroxisomas”, y en los humanos existen numerosas condiciones patológicas relacionadas con la deficiencia de esta enzima.
Índice del artículo
La actividad de enzimas como la catalasa puede variar considerablemente dependiendo del tipo de tejido que se considere. En mamíferos, por ejemplo, la actividad catalasa es significativa tanto en los riñones como en el hígado, y es mucho menor en los tejidos conectivos.
De modo que la catalasa en los mamíferos se asocia principalmente con todos los tejidos que presentan un metabolismo aeróbico significativo.
Los mamíferos poseen catalasas tanto en las mitocondrias como en los peroxisomas y en ambos compartimientos son enzimas asociadas con las membranas organelares. En los eritrocitos, por el contrario, la actividad catalasa está asociada con una enzima soluble (recuerde que los eritrocitos poseen escasos orgánulos internos).
La catalasa es una enzima con un alto número de recambio o constante catalítica (es muy veloz y eficiente) y la reacción general que cataliza es la siguiente:
2H2O2 → 2H2O + O2
En presencia de bajas concentraciones de peróxido de hidrógeno, la catalasa de mamíferos, por ejemplo, se comporta como una oxidasa, empleando en su lugar oxígeno molecular (O2) para oxidar moléculas como el indol y la β-feniletilamina, precursores del aminoácido triptófano y un neurotransmisor, respectivamente.
Algunos inhibidores competitivos de la actividad catalasa se conocen en la actualidad y entre ellos destacan la azida de sodio y el 3-aminotriazol. La azida, en su forma aniónica, es un potente inhibidor de otras proteínas con grupos hemo y es empleada para la eliminación o prevención del crecimiento de microorganismos en diferentes condiciones.
En los humanos, la catalasa es codificada por un gen de 34 kb que posee 12 intrones y 13 exones y que codifica para una proteína de 526 aminoácidos.
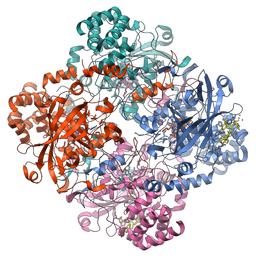
La mayoría de las catalasas estudiadas son enzimas tetraméricas con un peso molecular cercano a los 240 kDa (60 kDa por cada subunidad) y cada monómero está asociado con un grupo prostético hemina o ferroprotoporfirina.
Su estructura está conformada por cuatro dominios compuestos por estructuras secundarias formadas por hélices alfa y láminas β-plegadas, y estudios realizados en la enzima del hígado de humanos y bovinos han demostrado que estas proteínas están unidas a cuatro moléculas de NADPH.
Estas moléculas de NADPH no parecen ser esenciales para la actividad enzimática de la catalasa (para la producción de agua y oxígeno a partir de peróxido de hidrógeno), pero sí parece relacionarse con una disminución de la susceptibilidad de esta enzima frente a elevadas concentraciones de su tóxico sustrato.
Los dominios de cada subunidad en la catalasa de humanos son:
-Un brazo N-terminal extendido no-globular, que funciona para la estabilización de la estructura cuaternaria
-Un β-barril de ocho láminas β-plegadas antiparalelas ,que aportan algunos de los residuos de unión lateral al grupo hemo
-Un dominio de “envoltura” que rodea el dominio exterior, incluyendo al grupo hemo y, por último
-Un dominio con estructura de hélice alfa
Las cuatro subunidades, con estos cuatro dominios, se encargan de la formación de un largo canal cuyo tamaño es crítico para el mecanismo de reconocimiento del peróxido de hidrógeno por parte de la enzima (que emplea aminoácidos como histidina, asparagina, glutamina y ácido aspártico para ello).
Según algunos autores, la catalasa cumple dos funciones enzimáticas:
-La descomposición del peróxido de hidrógeno en agua y oxígeno molecular (como una peroxidasa específica).
-La oxidación de donadores de protones, como por ejemplo el metanol, etanol, muchos fenoles y ácido fórmico, empleando un mol de peróxido de hidrógeno (como una peroxidasa inespecífica).
-En los eritrocitos, la gran cantidad de catalasa parece jugar un papel importante en la protección de la hemoglobina frente agentes oxidantes, como el peróxido de hidrógeno, el ácido ascórbico, la metilhidrazina y otros.
La enzima presente en estas células se encarga de la defensa de otros tejidos con poca actividad catalasa frente a elevadas concentraciones de peróxido de hidrógeno.
-Algunos insectos como el escarabajo bombardero usan la catalasa como mecanismo de defensa, pues descomponen el peróxido de hidrógeno y emplean el oxígeno gaseoso producto de dicha reacción para propulsar la salida de agua y otros compuestos químicos en forma de vapor.
-En las plantas, la catalasa (también presente en los peroxisomas) es uno de los componentes del mecanismo de la fotorrespiración, durante el cual el fosfoglicolato producido por la enzima RuBisCO es empleado para la producción de 3-fosfoglicerato.
Las principales fuentes de producción del sustrato de la catalasa, el peróxido de hidrógeno, son las reacciones catalizadas por enzimas oxidasas, especies reactivas de oxígeno y algunas células tumorales.
Este compuesto está implicado en los procesos inflamatorios, en la expresión de moléculas adhesivas, en la apoptosis, en la regulación de la agregación de las plaquetas y en el control de la proliferación celular.
Cuando existen deficiencias de esta enzima se generan elevadas concentraciones de su sustrato, lo que produce lesiones en la membrana celular, defectos en el transporte electrónico en las mitocondrias, en el metabolismo de la homocisteína y en el ADN.
Entre las enfermedades asociadas con mutaciones en el gen codificante para la catalasa de humanos se pueden mencionar:
-Diabetes mellitus
-Hipertensión arterial
-Alzheimer
-Vitiligo y otras
- Agar, N., Sadrzadeh, S., Hallaway, P., & Eaton, J. (1986). Erythrocyte Catalase. A Somatic Oxidant Defense? J. Clin. Invest., 77, 319–321.
- Góth, L., Rass, P., & Páy, A. (2004). Catalase Enzyme Mutations and their Association with Diseases. Molecular Diagnosis, 8(3), 141–149.
- Kirkman, H., & Gaetanit, G. F. (1984). Catalase : A tetrameric enzyme with four tightly bound molecules of NADPH. Proc. Natl. Acad. Sci. USA, 81, 4343–4347.
- Kirkman, H. N., & Gaetani, G. F. (2006). Mammalian catalase: a venerable enzyme with new mysteries. Trends in Biochemical Sciences, 32(1), 44–50.
- Rawn, J. D. (1998). Biochemistry. Burlington, Massachusetts: Neil Patterson Publishers.
- Solomon, E., Berg, L., & Martin, D. (1999). Biology (5th ed.). Philadelphia, Pennsylvania: Saunders College Publishing.
- Vainshtein, B., Melik-Adamyan, W., Barynin, V., Vagin, A., & Grebenko, A. (1981). Three-dimensional structure of the enzyme catalase. Nature, 293(1), 411–412.
