Ácido brómico (HBrO3): propiedades, riesgos y usos
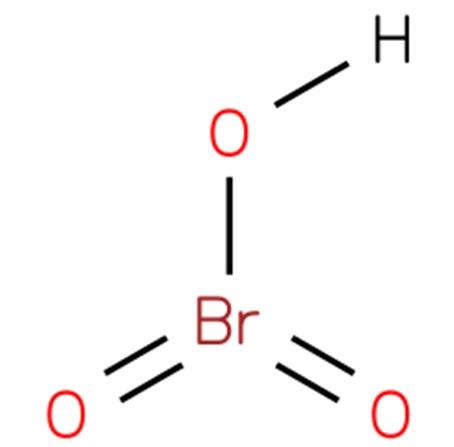
El ácido brómico, también conocido como bromato de hidrógeno o ácido brómico (V), es un compuesto químico de formula HBrO3. Se trata de un oxácido de bromo con una estructura análoga al ácido clórico (EMBL-EBI, 2014). El compuesto es un ácido muy fuerte. Su estructura se presenta en la figura 1 (EMBL-EBI, 2008 ).
Para preparar ácido brómico, un bromato soluble se disuelve usualmente en agua y se añade una sal de bario soluble. Precipita bromato de bario poco soluble.
El bromato de bario puede entonces disolverse en agua y acidificarse con ácido sulfúrico para precipitar el sulfato de bario básicamente insoluble y dejar atrás el ácido brómico (véase la imagen de arriba):
2KBrO3(aq) + BaCl2(aq) —> Ba(BrO3)2(s) + 2KCl(aq)
Ba(BrO3)2(aq) + H2SO4(aq) —> 2HBrO3 + BaSO4
El compuesto también puede producirse por la descomposición de pentacloruro de bromo en solución alcalina según la reacción:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
El ácido brómico es un fuerte agente oxidante. El ión bromato puede oxidarse adicionalmente con flúor elemental o difluoruro de xenón en presencia de base, la oxidación acompañada de pequeñas explosiones y el tubo de Teflón atrapado en el fuego (My Favorite Chemicals, S.F.).
Índice del artículo
El ácido brómico existe únicamente en solución incolora (hasta un 50% p/v) que se torna amarillenta en contacto con el aire (National Center for Biotechnology Information., 2017). Su apariencia se muestra en la figura 2.
El compuesto tiene un peso molecular de 128,91 g/mol y se descompone a 100 °C y tiene un pKa de -2. Al ser un compuesto inestable, sus propiedades físico-químicas fueron obtenidas mediantes cálculos computacionales.
Posee un punto de fusión de 206,04 °C, un punto de ebullición de 517,26 °C y una solubilidad en agua de 1 x 106 mg/l a 25 °C (Royal Society of Chemistry , 2015).
El compuesto es un fuerte agente oxidante. Al mezclarlo con etanol o éter se descompone formando ácido acético en una reacción exotérmica. Es fundamental para la elaboración de las sales de bromato (BrO3-) que se preparan haciendo reaccionar los carbonatos u óxidos de los metales con ácido brómico (Watts, 1870).
El ácido brómico es un compuesto inestable descomponiéndose a bromo elemental. Al ser un ácido fuerte, es extremadamente peligroso en caso de contacto con la piel (corrosivo e irritante), de contacto con los ojos (irritante) y en caso de ingestión. Muy peligroso también, en caso de inhalación.
Una sobreexposición severa puede producir daño pulmonar, asfixia, pérdida del conocimiento o muerte. La exposición prolongada puede causar quemaduras en la piel y ulceraciones. La sobreexposición por inhalación puede causar irritación respiratoria.
La inflamación del ojo se caracteriza por enrojecimiento, riego y picazón. La inflamación de la piel se caracteriza por picazón, descamación, enrojecimiento y ocasionalmente, formación de ampollas.
La sustancia es tóxica para los riñones, los pulmones y las membranas mucosas. La exposición repetida o prolongada a la sustancia puede producir daños en estos órganos.
Verificar si se están usando lentes de contacto y retirarlas inmediatamente. Se deben enjuagar los ojos con agua corriente durante al menos 15 minutos, manteniendo los párpados abiertos. Se puede usar agua fría. No se debe usar ungüento para los ojos.
Si el producto químico entra en contacto con la ropa, retírela lo más rápido posible, protegiendo sus propias manos y cuerpo. Coloque a la víctima bajo una ducha de seguridad.
Si el producto químico se acumula en la piel expuesta de la víctima, como las manos, se lava suave y cuidadosamente la piel contaminada con agua corriente y jabón no abrasivo. Se puede usar agua fría. Si la irritación persiste, busque atención médica. Lave la ropa contaminada antes de volver a usarla.
Si el contacto con la piel es grave, se debe lavar con un jabón desinfectante y cubrir la piel contaminada con una crema anti-bacteriana.
Es aconsejable dejar reposar a la víctima en un área bien ventilada. Si la inhalación es grave, se debe evacuar a la víctima a una zona segura tan pronto como sea posible. Afloje la ropa apretada tales como cuello de camisa, cinturones o corbata. Si a la víctima le resulta difícil respirar, se debe administrar oxígeno.
Si la víctima no está respirando, se realiza una resucitación boca a boca. Siempre tomando en cuenta que puede ser peligroso para la persona que proporciona ayuda dar reanimación boca a boca cuando el material inhalado es tóxico, infeccioso o corrosivo.
En caso de ingestión, no induzca el vómito. Afloje la ropa apretada tales como cuellos de camisa, cinturones o corbatas. Si la víctima no está respirando, realice la reanimación boca a boca.
En todos los casos se debe buscar atención médica inmediata.
El ácido brómico es usado como un poderoso agente oxidante en reacciones de laboratorio. Es usado para producir compuestos químicos como iodatos, ácido clórico, ácido tetraihónico entre otros.
También es usado para la producción de bromatos como el bromato de hierro, de plomo, de manganeso, de mercurio entre otros.
El ácido brómico actúa como un intermediario importante en la reacción de Bélousov-Zhabotinsky (Morris, 2010). Esta reacción es un ejemplo de relojes químico e ilustra una reacción de no equilibrio termodinámico.
La reacción de oscilación es catalizada por cerio y está inherentemente conectada a la química de los oxoácidos de bromo HBrOx. El creciente interés en los sistemas químicos no lineales ha proporcionado fuertes incentivos para estudiar la química del bromo.
En la reacción de Belousov-Zhabotinsky, los compuestos de bromo implicados son el ácido hipobromoso HOBr, el ácido bromoso HOBrO y ácido bromico HBrO3 (3) (Rainer Glaser, 2013).
Este tipo de reacciones son importantes para la química teórica. En ellas se muestran que las reacciones químicas no tienen que ser dominadas por el comportamiento termodinámico de equilibrio.
- Bromic Acid. (S.F.). Recuperado de chemyq.com.
- EMBL-EBI. (2008 , Mayo 16). bromic acid. Recuperado de ebi.ac.uk.
- EMBL-EBI. (2014, Julio 28). chloric acid. Recuperado de ebi.ac.uk.
- Morris, S. (2010, Enero 23). Belousov Zhabotinsky reaction 8 x normal speed. Recuperado de youtubecom.
- My Favorite Chemicals. (S.F.). Recuperado de bromicacid.com.
- National Center for Biotechnology Information. (2017, Marzo 11). PubChem Compound Database; CID=24445, . Recuperado de PubChem.
- Rainer Glaser, M. D. (2013). Why the Acidity of Bromic Acid Really Matters for Kinetic Models of Belousov-Zhabotinsky Oscillating Chemical Reactions. Journal of Thermodynamics & Catalysis 4:1.
- Royal Society of Chemistry . (2015). Bromic acid. Recuperado de chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, Volumen 1. Londres: longmans, green and co.
