Troponina: características, estructura, funciones y prueba
Troponina es el nombre que recibe una proteína presente en el músculo esquelético y cardíaco de los vertebrados, asociada con los filamentos en las fibras musculares y que tiene funciones en la regulación de la actividad contráctil (contracción y relajación muscular).
Las fibras musculares son las células que componen el tejido muscular, cuya capacidad de contracción se basa en la interacción entre unos filamentos que se encuentran ordenados y estrechamente asociados en su interior, ocupando la mayor parte del volumen citoplásmico.
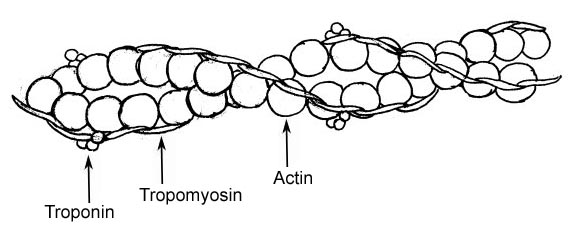
Estos filamentos se conocen como miofilamentos y los hay de dos clases: los gruesos y los delgados. Los filamentos gruesos están compuestos por moléculas de miosina II, mientras que los filamentos delgados son polímeros de actina globular o actina G en asociación con otras dos proteínas.
Tanto la actina como la miosina se encuentran también en otras células del cuerpo humano y otros organismos, sólo que en mucha menor proporción y participando en procesos diferentes como la migración celular, la exocitosis, en la citocinesis (durante la división celular) e incluso en el tráfico vesicular intracelular.
La troponina y la tropomiosina son las dos proteínas asociadas con los filamentos delgados de actina que participan en la regulación de los procesos de contracción y relajación de las miofibrillas de las células o fibras musculares.
Los mecanismos de acción a través de los cuales estas dos proteínas ejercen su función están relacionados con la concentración intracelular de calcio. El sistema de regulación de la troponina es uno de los sistemas mejor conocidos en la fisiología y bioquímica de la contracción del músculo esquelético.
Estas proteínas son de gran importancia para el organismo. En la actualidad se sabe a ciencia cierta que algunas cardiomiopatías familiares o congénitas son producto de mutaciones en la secuencia de los genes que codifican para alguna de las dos (troponina o tropomiosina).
Índice del artículo
La troponina se encuentra asociada a la actina de los filamentos delgados de las fibras musculares en el músculo esquelético y cardíaco en una relación estequiométrica de 1 a 7, es decir, una molécula de troponina por cada 7 moléculas de actina.
Esta proteína, como se ha destacado, se encuentra exclusivamente en los filamentos contenidos en el interior de las miofibrillas de las fibras musculares estriadas esqueléticas y cardíacas, y no en las fibras musculares lisas que componen la musculatura vascular y visceral.
Es concebida por algunos autores como la proteína reguladora de la tropomiosina. Al igual que esta, posee sitios de unión para la interacción con las moléculas de actina, lo que le confiere la capacidad de regular la interacción de esta con la miosina de los filamentos gruesos.
En los miofilamentos la relación entre las moléculas de troponina y tropomiosina es de 1 a 1, lo que quiere decir que por cada complejo de troponina que existe hay una molécula de tropomiosina asociada a este.
La troponina es un complejo proteico compuesto por tres subunidades globulares diferentes conocidas como troponina I, troponina C y troponina T, que juntas suman, más o menos, 78 kDa.
En el cuerpo humano existen variantes tejido-específicas para cada una de estas subunidades, que se diferencian entre sí tanto a nivel genético y molecular (con respecto a los genes que las codifican), como a nivel estructural (respecto a sus secuencias aminoacídicas).
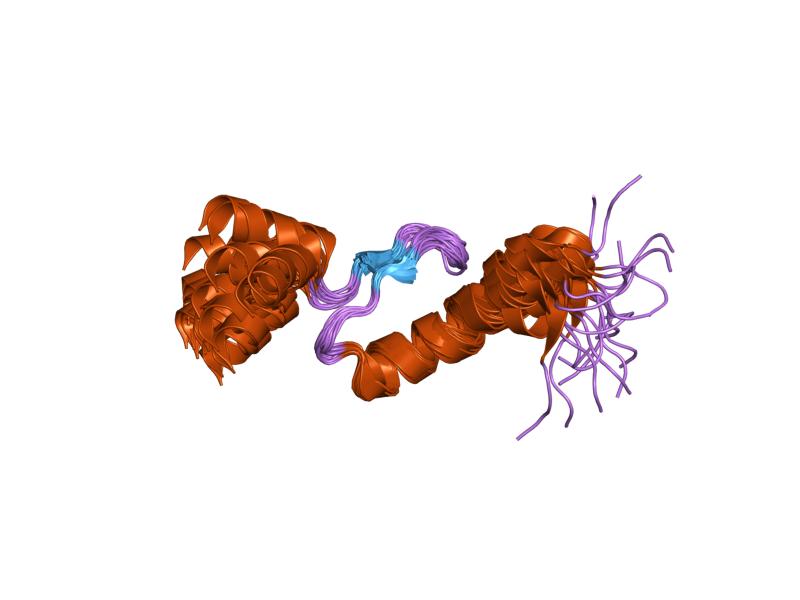
La troponina C o TnC es la más pequeña de las tres subunidades y quizá una de las más importantes. Tiene 18 kDa de peso molecular y posee sitios para unirse al calcio (Ca2+).
La troponina T o TnT es la que posee los sitios de unión para anclar el complejo de las tres subunidades a la tropomiosina y tiene 30 kDa de peso molecular; también se conoce como subunidad T o subunidad de unión a tropomiosina.
La troponina I o TnI, de poco más de 180 residuos aminoacídicos, tiene el mismo peso molecular que la troponina T, pero en su estructura posee los sitios especiales para unirse a la actina, bloqueando la interacción entre esta última y la miosina, que es el fenómeno responsable de la contracción de las fibras musculares.
Muchos libros de texto se refieren a esta subunidad como la subunidad inhibitoria y como la “pega” molecular entre las tres subunidades de la troponina. Su capacidad de unión a la actina y su actividad inhibitoria son potenciadas por su asociación con la tropomiosina, mediada por la subunidad TnT.
Se ha demostrado que, en la subunidad I, la región de la secuencia encargada de la inhibición está definida por un péptido central de 12 residuos aminoacídicos entre las posiciones 104 y 115; y que la región C-terminal de la subunidad también tiene una función durante la inhibición.
La función principal de la troponina en la contracción muscular depende de su capacidad de unirse al calcio, ya que esta proteína es el único componente de los filamentos delgados en el músculo estriado que tiene esta propiedad.
En ausencia de troponina, los filamentos delgados son capaces de unirse a los filamentos gruesos y contraerse, independientemente de la concentración de calcio intracelular, por lo que la función de la troponina es evitar la contracción en ausencia de calcio mediante su asociación con la tropomiosina.
Así, la troponina juega un importante papel en el mantenimiento de la relajación muscular cuando no hay suficiente calcio intracelular, y en la contracción muscular cuando el estímulo eléctrico nervioso permite la entrada de calcio a la fibra muscular.
En los músculos estriados esqueléticos y cardíacos, la contracción muscular ocurre gracias a la interacción entre los filamentos delgados y gruesos que se deslizan unos sobre los otros.
En las células de estos músculos el calcio es fundamental para que ocurra la interacción acto-miosina (filamentos delgados y gruesos) ,puesto que los sitios de unión de la actina para la miosina están “escondidos” por la acción conjunta de la tropomiosina y la troponina, que es la que responde al calcio.
Los iones de calcio que provienen del retículo sarcoplásmico (el retículo endoplásmico de las fibras musculares) se unen a la subunidad C de la troponina, lo que neutraliza la inhibición mediada por la troponina y se dispara la contracción muscular.
La “neutralización” de la inhibición causada por la subunidad I ocurre tras la unión del calcio a la subunidad C, lo que genera un cambio conformacional que se propaga entre las tres subunidades y permite su disociación tanto de las moléculas de actina como de la tropomiosina.
Esta disociación entre troponina, tropomiosina y actina deja al descubierto en la actina los sitios de unión para la miosina. Es entonces cuando las cabezas globulares de esta última pueden interactuar con las fibras de actina e iniciar la contracción ATP-dependiente por desplazamiento de un filamento sobre el otro.
La troponina es el biomarcador preferido para la detección de lesiones cardíacas. Por ello, la prueba de la troponina es muy utilizada en el diagnóstico bioquímico, temprano y/o preventivo, de algunas condiciones patológicas cardíacas como el infarto agudo de miocardio.
Muchos médicos tratantes consideran que esta prueba facilita la toma de decisiones con respecto a qué hacer y a qué tratamiento administrar a los pacientes que presentan dolor en el pecho.
Por lo general, se relaciona con la detección de las subunidades T e I de la troponina, puesto que la isoforma de troponina C también se encuentra en los músculos esqueléticos de contracción lenta; es decir, no es específica del corazón.
La prueba de la troponina suele ser un ensayo inmunológico que detecta las isoformas cardíacas de las subunidades T e I de la troponina. Entonces, se basa en las diferencias que existen entre ambas isoformas.
En el tejido muscular del miocardio existe solo una isoforma de la subunidad I de la troponina, caracterizada por la presencia de una “cola” postraduccional de 32 aminoácidos en su extremo N-terminal.
Esta isoforma es detectada gracias al desarrollo de anticuerpos monoclonales específicos que no reconocen otras isoformas no-cardíacas, puesto que la cola de aminoácidos es más o menos 50% diferente a los extremos de otras isoformas.
La cTnI no se expresa en tejidos dañados, sino que es exclusiva para el tejido cardíaco adulto.
La isoforma cardíaca de la subunidad T de la troponina está codificada en tres genes diferentes, cuyos ARNm pueden sufrir cortes y empalmes alternativos que dan como resultado la producción de isoformas con secuencias variables en los extremos N- y C-terminales.
A pesar de que el músculo cardíaco de los seres humanos contiene 4 isoformas de la TnT, solo una es característica del tejido cardíaco de un adulto. Esta es detectada con anticuerpos específicos diseñados contra el extremo N-terminal de su secuencia aminoacídica.
Las pruebas de “nueva generación” para la subunidad T de la isoforma cardíaca prestan mucha atención al hecho de que algunos tejido musculares esqueléticos lesionados pueden re-expresar esta isoforma, por lo que se pueden obtener reacciones cruzadas con los anticuerpos.
- Babuin, L., & Jaffe, A. S. (2005). Troponin: the biomarker of choice for the detection of cardiac injury. CMAJ, 173(10), 1191–1202.
- Collinson, P., Stubbs, P., & Kessler, A.-C. (2003). Multicentre evaluation of the diagnostic value of cardiac troponin T, CK-MB mass, and myoglobin for assessing patients with suspected acute coronary syndromes in routine clinical practice. Heart, 89, 280–286.
- Farah, C., & Reinach, F. (1995). The troponin complex and regulation of muscle contraction. FASEB, 9, 755–767.
- Keller, T., Peetz, D., Tzikas, S., Roth, A., Czyz, E., Bickel, C., … Blankenberg, S. (2009). Sensitive Troponin I Assay in Early Diagnosis of Acute Myocardial Infarction. The New England Journal of Medicine, 361(9), 868–877.
- Ross, M., & Pawlina, W. (2006). Histology. A Text and Atlas with correlated cell and molecular biology (5th ed.). Lippincott Williams & Wilkins.
- Wakabayashi, T. (2015). Mechanism of the calcium-regulation of muscle contraction. In pursuit of its structural basis. Proc. Jpn. Acad. Ser. B, 91, 321–350.
