¿Qué es la Molalidad? (con Ejemplos)
La molalidad, denotado con la letra m en minúscula, es un término usado para describir la concentración de una solución. Se puede definir como el número de moles de un soluto disueltos en 1 kilogramo de solvente.
Es igual a los moles de soluto (la sustancia que se disuelve) dividida por los kilogramos de disolvente (la sustancia usada para disolverse).
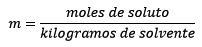
Donde los moles de soluto vienen dado por la ecuación:
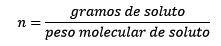
Por lo que a la final, la ecuación de molalidad queda
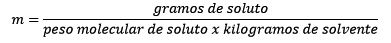
Características de la molalidad
La molalidad es una medida de la concentración de un soluto en una solución. Se utiliza principalmente cuando la temperatura es una preocupación.
La molalidad no es tan común como su contraparte, la molaridad (moles de soluto por cada litros de solvente), pero se utiliza en cálculos muy específicos, especialmente en lo que respecta a las propiedades coligativas (elevación del punto de ebullición, depresión del punto de congelación).
Dado que el volumen está sujeto a variación debido a la temperatura y presión, la molaridad también varía según la temperatura y la presión. En algunos casos, el uso de peso es una ventaja porque la masa no varía con las condiciones ambientales.
Es importante que se use la masa de disolvente y no la masa de la solución. Las disoluciones marcadas con concentración molal se indican con una m minúscula. Una solución de 1,0 m contiene 1 mol de soluto por kilogramo de disolvente.
La preparación de una solución de una molalidad dada es fácil porque sólo requiere una buena escala. Tanto el disolvente como el soluto se mezclan, en lugar de medirse por volumen.
La unidad SI (sistema internacional) para molalidad es mol/kg, o moles soluto por kg de disolvente. Una solución con una molalidad de 1 mol/kg se describe a menudo como “1 molal” o “1 m”.
Sin embargo, siguiendo el sistema de unidades SI, el Instituto Nacional de Estándares y Tecnología, que es la autoridad de los Estados Unidos sobre la medición, considera que el término “molal” y el símbolo de unidad “m” están obsoletos y sugiere usar mol/kg.
Diferencias y similitudes entre molalidad (m) y molaridad (M)
La preparación de una solución de una molalidad dada implica pesar tanto el soluto como el disolvente y obtener sus masas.
Pero en el caso de la molaridad, se mide el volumen de la solución, lo que deja espacio para variaciones de densidad como resultado de la condición ambiental de temperatura y presión.
Esto significa que es ventajoso trabajar con la molalidad que trata con la masa porque en la composición química, la masa de una sustancia pura conocida es más importante que su volumen ya que los volúmenes pueden alterarse bajo el efecto de la temperatura y la presión mientras la masa permanece sin cambios.
Además, las reacciones químicas tienen lugar en proporción de masa, y no de volumen. Para ser basado en la masa, la molalidad se puede convertir fácilmente en una relación de masa o una fracción de masa.
Para soluciones acuosas (soluciones en las que el agua es el disolvente) cerca de la temperatura ambiente, la diferencia entre las soluciones molales y molares es despreciable.
Esto es porque alrededor de la temperatura ambiente, el agua tiene una densidad de 1 kg / L. Esto significa que el “por L” de molaridad es igual al “por kg” de molalidad.
Para un disolvente como el etanol, donde la densidad es 0,789 kg / l, una solución 1 M sería 0,789 m.
La parte importante de recordar la diferencia es:
Molaridad – M → moles por litro de solución.
Molalidad – m → moles por kilogramo de solvente.
Ejemplos de molalidad
Ejemplo 1:
Problema: ¿Cuál es la molalidad de una solución que contiene 0.086 moles de NaCl disuelto en 25,0 g de agua?
Respuesta: en este ejemplo se usa la ecuación directa de molalidad:
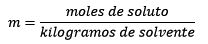
Moles de soluto (NaCl) = 0,086 mol
Masa (agua) = 25,0 g = 25,0 x 10-3 kg
Sustituyendo se tiene:
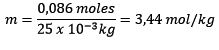
Ejemplo 2:
Problema: ¿Cuál es la molalidad de una solución si 124,2 gramos de NaOH se disuelven en 1,00 litros de agua? (La densidad del agua es igual a 1,00 g/ml).
Respuesta: El agua se conoce como el disolvente universal y la densidad se suele dar como 1,00 gramos por mililitro, o lo que es lo mismo 1 kilogramo por litro. Esto facilita la conversión de litros a kilogramos.
En este problema los 124,2 gramos de NaOH tendrán que ser convertidos en moles (para moles de soluto) y un litro de agua tendrá que ser convertido en kilogramos (por kilogramos de disolvente) usando la densidad.
En primer lugar, se encuentra la masa molar de NaOH:
PMNa= 22,99 g/mol
PMO= 16 g/mol
PMH= 1g/mol
PMNaOH= 22,99 g/mol +16 g/mol +1 g/mol =39,99 g/mol
En segundo lugar, se convierte los gramos de NaOH en moles, utilizando la masa molar:
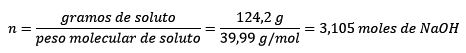
En tercer lugar, se convierte el litro de agua en kilogramos usando la densidad.
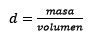
Despejando la masa queda
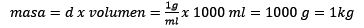
Finalmente se resuelve la ecuación de molalidad:
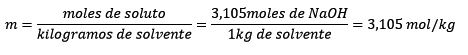
Ejemplo 3:
Problema: ¿Cuál es la masa de agua de una solución acuosa que contiene 0,52 gramos de cloruro de bario (BaCl2, PM= 208,23 g/mol) cuya concentración es 0,005 mol/kg?
Respuesta: en este caso se usa la concentración molal para determinar la cantidad de agua en solución.
En primer lugar se obtiene el número de moles de BaCl2 en la solución:
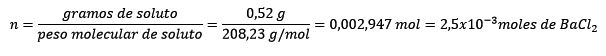
En segundo lugar, se despeja de la ecuación de molalidad los kilogramos de solvente y se resuelve.
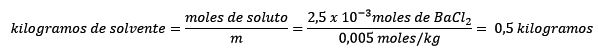
Referencias
- Science Notes and Projects. (2015, Febrero 22). Calculating Molality Example Problem. Recuperado de sciencenotes.org.
- Bhardwaj, M. (2014, Noviembre 26). What’s an example of molality? Recuperado de socratic.org.
- (S.F.). Molality. Recuperado de boundless.com.
- Helmenstine, T. (2017, Febrero 19). What is the Difference Between Molarity and Molality? Recuperado de thoughtco.com.
- Molality Formula. (S.F.). Recuperado de softschools.com.
- Molality. (S.F.). Recuperado de chemteam.l
- What is Molality? (S.F.). Recuperado de freechemistryonline.com.
