Agente oxidante: concepto, los más fuertes, ejemplos
Un agente oxidante es una sustancia química que tiene la capacidad de sustraer electrones de otra sustancia (agente reductor) que los dona o pierde. También se conoce como agente oxidante a aquel elemento o compuesto que traspasa átomos electronegativos a otra sustancia.
Cuando se estudian las reacciones químicas, deben tomarse en cuenta todas las sustancias que intervienen y los procesos que ocurren en estas. Entre las más importantes se tienen las reacciones de óxido-reducción, también llamadas redox, que involucran la transferencia o traspaso de electrones entre dos o más especies químicas.
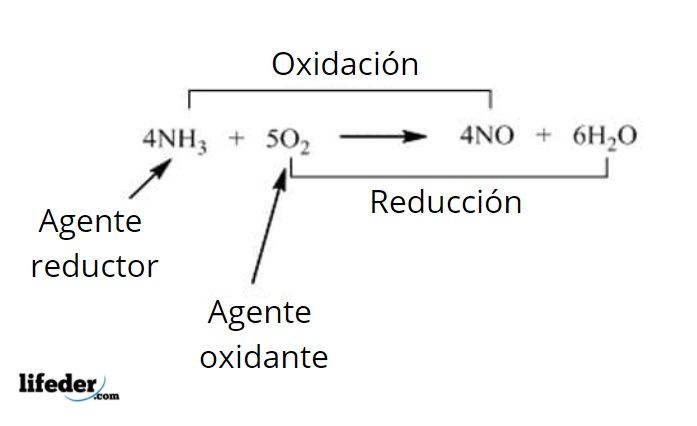
En estas reacciones interactúan dos sustancias: el agente reductor y el agente oxidante. Algunos de los agentes oxidantes que se pueden observar más frecuentemente son oxígeno, hidrógeno, ozono, nitrato de potasio, perborato de sodio, peróxidos, halógenos y compuestos de permanganato, entre otros.
El oxígeno se considera el más común de los agentes oxidantes. Como ejemplo de estas reacciones orgánicas que involucran la transferencia de átomos destaca la combustión, que consiste en una reacción producida entre el oxígeno y algún otro material de carácter oxidable.
Índice del artículo
- 1 ¿En qué consisten los agentes oxidantes?
- 2 ¿Qué factores definen la fortaleza de un agente oxidante?
- 3 Los agentes oxidantes más fuertes
- 4 Ejemplos de reacciones con agentes oxidantes
- 5 Referencias
En la semirreacción de oxidación el agente oxidante es reducido debido a que, al recibir electrones del agente reductor, se induce una disminución en el valor de la carga o número de oxidación de uno de los átomos del agente oxidante.
Esto puede explicarse mediante la siguiente ecuación:
2Mg(s) + O2(g) → 2MgO(s)
Se puede observar que el magnesio (Mg) reacciona con el oxígeno (O2), y que el oxígeno es el agente oxidante debido a que sustrae electrones del magnesio —es decir, se está reduciendo— y el magnesio se convierte, a su vez, en el agente reductor de esta reacción.
Del mismo modo, la reacción entre un agente oxidante fuerte y un agente reductor fuerte puede ser muy peligrosa porque estos pueden interactuar de manera violenta, así que deben ser almacenados en sitios separados.
Estas especies se distinguen de acuerdo a su “fortaleza”. Es decir, los más débiles son aquellos que tienen una menor capacidad de sustraer electrones de otras sustancias,.
En cambio, los más fuertes tienen mayor facilidad o capacidad para “arrancar” estos electrones. Para su diferenciación se consideran las siguientes propiedades:
Se conoce como la mitad de la distancia que separa los núcleos de dos átomos de elementos metálicos colindantes o “vecinos”.
Los radios atómicos son determinados generalmente por la fuerza con la que son atraídos los electrones más superficiales al núcleo del átomo.
Por lo tanto, el radio atómico de un elemento decrece en la tabla periódica de abajo hacia arriba y de izquierda a derecha. Esto implica que, por ejemplo, el litio tiene un radio atómico significativamente más grande que el flúor.
La electronegatividad se define como la habilidad que posee un átomo para captar hacia sí mismo electrones pertenecientes a un enlace químico. A medida que aumenta la electronegatividad, los elementos presentan una tendencia creciente para atraer los electrones.
En términos generales, la electronegatividad se incrementa de izquierda a derecha en la tabla periódica y disminuye mientras el carácter metálico crece, siendo el flúor el elemento más electronegativo.
Se dice que es la variación de la energía que se registra cuando un átomo recibe un electrón para generar un anión; es decir, es la habilidad de una sustancia para recibir uno o más electrones.
A medida que aumenta la afinidad electrónica se incrementa la capacidad oxidativa de una especie química.
Es la mínima cantidad de energía que se necesita para arrancar un electrón de un átomo o, dicho de otra manera, es una medida de la “fuerza” con la que un electrón está ligado a un átomo.
Mientras más grande sea el valor de esta energía, se dificulta más el desprendimiento de un electrón. Así, la energía de ionización se agranda de izquierda de derecha y se reduce de arriba hacia abajo en la tabla periódica. En este caso, los gases nobles presentan valores grandes de energías de ionización.
Tomando en cuenta estos parámetros de los elementos químicos, es posible determinar cuáles son las características que deben tener los mejores agentes oxidantes: alta electronegatividad, bajo radio atómico y alta energía de ionización.
Dicho esto, se considera que los mejores agentes oxidantes son las formas elementales de los átomos más electronegativos, y se observa que el agente oxidante más débil es el sodio metálico (Na+) y el más fuerte es la molécula de flúor elemental (F2), que es capaz de oxidar una gran cantidad de sustancias.
En algunas reacciones de óxido-reducción es más fácil visualizar la transferencia de electrones que en las demás. A continuación se explicarán algunos de los ejemplos más representativos:
La reacción de descomposición del óxido de mercurio:
2HgO(s) → 2Hg(l) + O2(g)
En esta reacción se distingue al mercurio (agente oxidante) como el receptor de los electrones del oxígeno (agente reductor), descomponiéndose en mercurio líquido y oxígeno gaseoso al calentarse.
Otra reacción que ejemplifica la oxidación es la del azufre quemándose en presencia de oxígeno para formar dióxido de azufre:
S(s) + O2(g) → SO2(g)
Aquí se puede observar que la molécula de oxígeno se oxida (agente reductor), mientras el azufre elemental se reduce (agente oxidante).
Finalmente, la reacción de combustión del propano (utilizado en el gas para calefacción y cocina):
C3H8(g) + 5O2(g) → 3CO2(g) + 2H2O(l)
En esta fórmula se puede observar la reducción del oxígeno (agente oxidante).
- Reducing agent. Recuperado de en.wikipedia.org
- Chang, R. (2007). Chemistry, Ninth edition (McGraw-Hill).
- Malone, L. J., y Dolter, T. (2008). Basic Concepts of Chemistry. Recuperado de books.google.co.ve
- Ebbing, D., y Gammon, S. D. (2010). General Chemistry, Enhanced Edition. Recuperado de books.google.co.ve
- Kotz, J., Treichel, P., y Townsend, J. (2009). Chemistry and Chemical Reactivity, Enhanced Edition. Recuperado de books.google.co.ve
