Agente reductor: concepto, los más fuertes, ejemplos
Un agente reductor es una sustancia que cumple la función de reducir a un agente oxidante en una reacción de óxido-reducción. Los agentes reductores son donantes de electrones por naturaleza, típicamente sustancias que se encuentran en sus niveles más bajos de oxidación y con una cantidad alta de electrones.
Existe una reacción química en la que los estados de oxidación de los átomos varían. Estas reacciones involucran un proceso de reducción y otro de oxidación complementario. En estas reacciones, uno o más electrones de una molécula, átomo o ión se transfieren a otra molécula, átomo o ión. Esto implica la producción de una reacción de óxido-reducción.
Durante el proceso de óxido-reducción, aquel elemento o compuesto que pierde (o dona) su electrón (o electrones) se hace llamar un agente reductor, contrastando con aquel agente oxidante que es el receptor de electrones. Se dice entonces que los agentes reductores reducen al agente oxidante, y que el agente oxidante oxida al agente reductor.
Los mejores o más fuertes agentes reductores son aquellos que poseen mayor radio atómico; es decir, que poseen una distancia más grande desde su núcleo hasta los electrones que rodean al mismo.
Los agentes reductores suelen ser metales o iones negativos. Entre los agentes reductores comunes se encuentran ácido ascórbico, azufre, hidrógeno, hierro, litio, magnesio, manganeso, potasio, sodio, vitamina C, zinc e incluso el extracto de zanahorias.
Índice del artículo
- 1 ¿En qué consisten los agentes reductores?
- 2 Factores que determinan la fuerza de un agente reductor
- 3 Agentes reductores más fuertes
- 4 Ejemplos de reacciones con agentes reductores
- 5 Referencias
Como ya se dijo, los agentes reductores se encargan de disminuir a un agente oxidante cuando se produce una reacción de óxido-reducción.
Una reacción sencilla y típica de la reacción de óxido-reducción es la de la respiración celular aeróbica:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
En este caso, donde la glucosa (C6H12O6) está reaccionando con el oxígeno (O2), la glucosa está comportándose como el agente reductor para ceder electrones al oxígeno —es decir, está siendo oxidado— y el oxígeno se convierte en agente oxidante.
En la química orgánica se consideran los mejores agentes reductores aquellos reactivos que proporcionan hidrógeno (H2) a la reacción. En este campo de la química, la reacción de reducción se refiere a la adición de hidrógeno a una molécula, aunque la definición anterior (reacciones de óxido-reducción) también aplica.
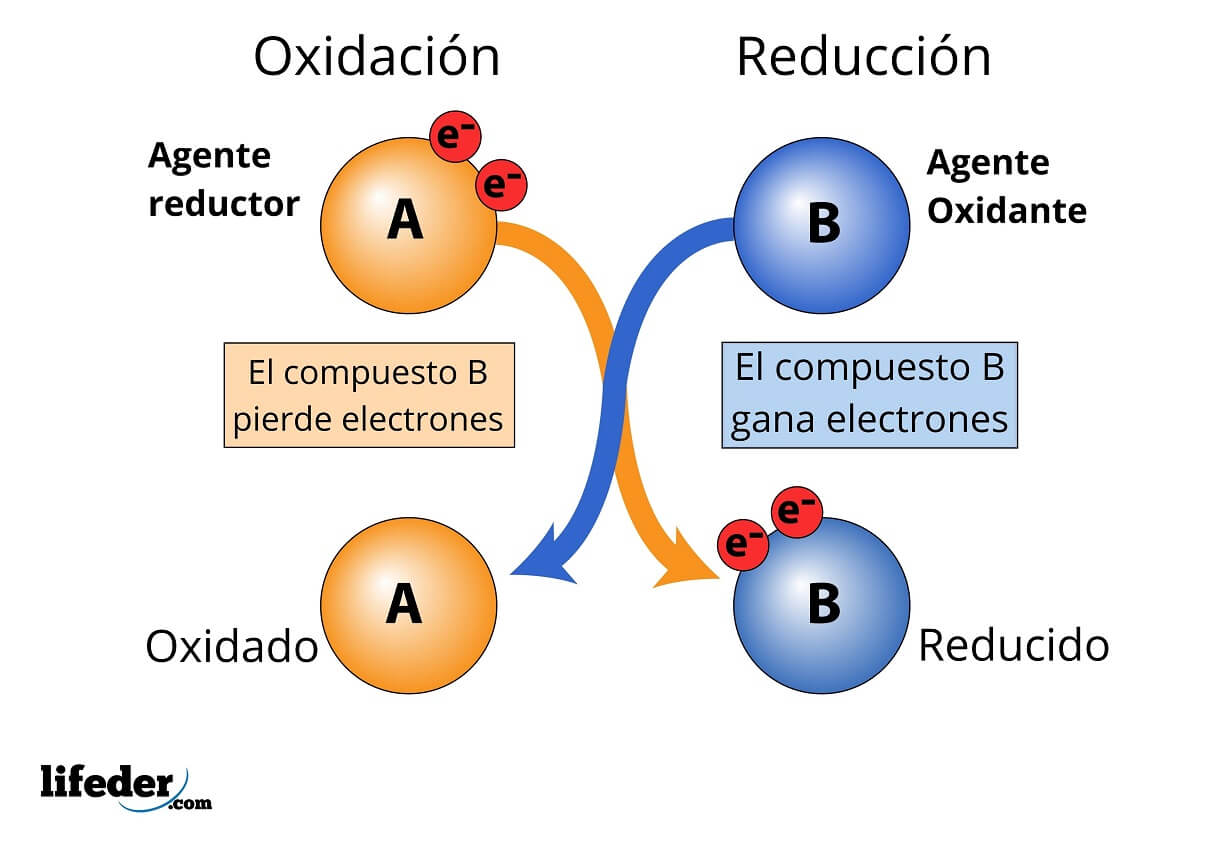
Para que una sustancia sea considerada “fuerte” se espera que sean moléculas, átomos o iones que se desprendan más o menos fácilmente de sus electrones.
Para esto, existe una serie de factores que deben tomarse en cuenta para reconocer la fuerza que pueda tener un agente reductor: la electronegatividad, el radio atómico, la energía de ionización y el potencial de reducción.
La electronegatividad es la propiedad que describe la tendencia de un átomo de atraer un par de electrones unidos hacia él mismo. Mientras más alta la electronegatividad, mayor será la fuerza de atracción que ejerce el átomo sobre los electrones que lo rodean.
En la tabla periódica la electronegatividad se incrementa desde la izquierda hasta la derecha, por lo que los metales alcalinos son los elementos menos electronegativos.
Es la propiedad que mide la cantidad de los átomos. Se refiere a la distancia típica o promedio del centro de un núcleo atómico a la frontera de la nube electrónica que lo rodea.
Esta propiedad no es precisa —y además, se involucran varias fuerzas electromagnéticas en su definición— pero se sabe que este valor va disminuyendo de izquierda a derecha en la tabla periódica, y aumentando de arriba hacia abajo. Es por esto que los metales alcalinos, especialmente el cesio, se consideran de mayor radio atómico.
Esta propiedad se define como la energía requerida para remover el electrón menos unido de un átomo (el electrón de valencia) para formar un catión.
Se dice que mientras más cercano estén los electrones al núcleo del átomo que rodean, mayor será la energía de ionización del átomo.
La energía de ionización aumenta de izquierda de derecha y de abajo hacia arriba en la tabla periódica. De nuevo, los metales (especialmente los alcalinos) poseen menor energía de ionización.
Es la medida de la tendencia de una especie química a obtener electrones y, por lo tanto, a ser reducida. Cada especie posee un potencial de reducción intrínseco: mientras mayor sea el potencial, mayor será la afinidad de la misma con los electrones y también su capacidad de ser reducida.
Los agentes reductores son aquellas sustancias con menor potencial de reducción, por su poca afinidad con los electrones.
Con los factores anteriormente descritos se puede concluir que para encontrar un agente reductor “fuerte” se desea un átomo o molécula con baja electronegatividad, alto radio atómico y baja energía de ionización.
Como ya se ha mencionado, los metales alcalinos presentan estas características y son considerados los más fuertes agentes reductores.
Por otra parte, el litio (Li) es considerado el agente reductor más fuerte por poseer el menor potencial de reducción, mientras que la molécula LiAlH4 se considera como el más fuerte agente reductor de todos, por contener esta y las otras características deseadas.
Existen muchos casos de óxido-reducción en la vida cotidiana. A continuación se detallarán algunos de los más representativos:
La reacción de combustión del octano (el componente principal de la gasolina):
2C8H18(l) + 25O2 → 16CO2(g) + 18H2O(g)
Se puede observar cómo el octano (agente reductor) dona electrones al oxígeno (agente oxidante), formando dióxido de carbono y agua en grandes cantidades.
La hidrólisis de la glucosa es otro ejemplo útil de una reducción común:
C6H12O6 + 2ADP + 2P + 2NAD+ → 2CH3COCO2H + 2ATP + 2NADH
En esta reacción las moléculas de NAD (un receptor de electrones y agente oxidante en esta reacción) toman electrones de la glucosa (agente reductor).
Por último, en la reacción del óxido férrico
Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(l)
El agente reductor es el aluminio, mientras que el agente oxidante es el hierro.
- Wikipedia. (s.f.). Wikipedia. Obtenido de en.wikipedia.org
- BBC. (s.f.). BBC.co.uk. Obtenido de bbc.co.uk
- Pearson, D. (s.f.). Chemistry LibreTexts. Obtenido de chem.libretexts.org
- Research, B. (s.f.). Bodner Research Web. Obtenido de chemed.chem.purdue.edu
- Peter Atkins, L. J. (2012). Chemical Principles: The Quest for Insight.
