Afinidad electrónica: concepto, interpretación, ejemplos, tablas
¿Qué es la afinidad electrónica?
La afinidad electrónica se define como la cantidad de energía liberada cuando un mol de átomos en estado gaseoso se combina con un mol de electrones para formar un mol de aniones, también en estado gaseoso. En otras palabras, se refiere al negativo de la variación de entalpía del siguiente proceso:
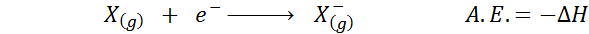
Como su nombre lo indica, la afinidad electrónica (A.E.) es una medida de la tendencia que tiene un átomo a unirse a un electrón. Es decir, mide la afinidad de un átomo por los electrones.
Interpretación de la afinidad electrónica
Debido a la forma como se define, una afinidad electrónica alta implica que la variación de entalpía es muy negativa. Esto, a su vez indica que el proceso es favorable energéticamente y que los productos son más estables que los reactivos. Por esta razón, también podríamos decir que la afinidad electrónica es una medida indirecta de la estabilidad de un anión.
Mientras mayor sea la afinidad electrónica de un átomo, mayor tendencia tendrá para formar el anión. Es por esto que átomos como el cloro, cuya afinidad electrónica es de 349 kJ/mol, tienden a formar aniones fácilmente (en este caso el anión cloruro), mientras que otros átomos como el magnesio, cuya afinidad electrónica es negativa, no forman aniones.
Aclaratoria sobre la afinidad electrónica y la energía de ionización
Muchas veces se piensa en la afinidad electrónica como el contrario de la energía de ionización (la tendencia de un átomo gaseoso a perder un electrón), pero esto no es así. Consideremos, por ejemplo, un átomo X.
Su afinidad electrónica se refiere al cambio de energía del proceso mostrado anteriormente en la primera ecuación. Sin embargo, su energía de ionización se refiere al cambio de energía cuando el átomo pierde un electrón:
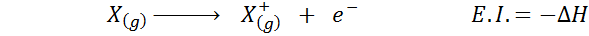
A pesar de que esta reacción pareciera ser la reacción opuesta a la anterior, no es así (observe que las cargas eléctricas no son iguales en ninguno de los dos casos).
¿Qué determina la afinidad electrónica?
Para saber qué características de un átomo influyen sobre el valor de su afinidad electrónica, se debe considerar la estabilidad del átomo original, así como la del anión que se forma. Si el anión es más estable que el átomo, entonces la afinidad electrónica será alta, de lo contrario será baja o, incluso, negativa.
Pero, ¿Cómo saber cuál de las dos especies es más estable? Para eso, nos basamos en dos factores:
- Configuración electrónica. Hay configuraciones electrónicas más estables que otras. En general, la configuración de capa llena (como la de los gases nobles) es la más estable de todas. Luego le sigue la configuración de capa semi-llena, en la que todos los orbitales de la capa de valencia tienen la mitad de los electrones que podrían tener (por ejemplo, 4s14p3).
- La repulsión electrónica. Si se compara un anión de carga -1, con un anión de carga -2, en el segundo caso habrá mucha más repulsión entre los electrones, lo que desestabiliza al anión.
Tendencia periódica de la afinidad electrónica
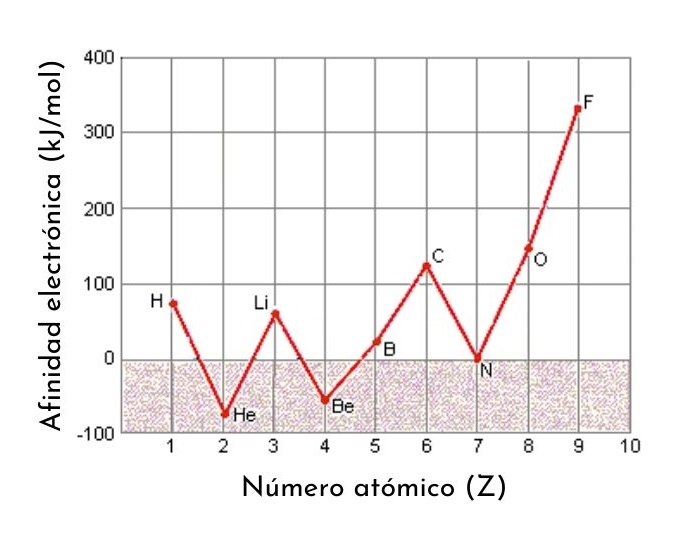
La afinidad electrónica es una de las propiedades periódicas de los elementos. Es decir, es una propiedad que varía predeciblemente de un elemento a otro en función de su posición en la tabla periódica. En términos generales, la afinidad electrónica aumenta a medida que el tamaño del átomo disminuye.
En este sentido, el tamaño de los átomos varía en función del período y del grupo en el que se encuentre, por lo que también varía su afinidad electrónica como se explica a continuación:
Variación de la afinidad electrónica a lo largo de un período
Por lo menos para los elementos representativos (los pertenecientes a los bloques s y p de la tabla periódica), se puede observar que la afinidad electrónica tiene una tendencia general de aumentar de izquierda a derecha, debido al aumento en la carga nuclear efectiva que es capaz de atraer con mayor fuerza a los electrones.
Por ejemplo, si tomamos el 3er período de la tabla periódica, podemos ver que la afinidad electrónica del Li (60 kJ/mol) es menor que la del oxígeno (141 kJ/mol) y esta es menor que la del flúor (328 kJ/mol).
Excepciones
La regla anterior no siempre se cumple.
En primer lugar, al pasar de los metales alcalinos a los alcalinotérreos, la afinidad electrónica disminuye. Esto se debe a que para los metales alcalinos (configuración electrónica ns1) es favorable captar un electrón, ya que así terminarían de llenar su orbital s.
En el caso de los alcalinotérreos (configuración electrónica ns2) captar un electrón resulta desfavorable debido a que ya tienen su orbital s lleno. Lo mismo sucede al pasar de los halógenos (que tienen las afinidades electrónicas mayores de todos los elementos) a los gases nobles.
Variación de la afinidad electrónica a lo largo de un grupo
En el caso de los grupos, el comportamiento es incluso menos predecible. La regla general es que la A.E. aumenta de abajo hacia arriba, en la misma dirección que disminuye el radio atómico. Para los metales alcalinos y los halógenos, esta regla se cumple bastante bien. Sin embargo, esto no sucede con la mayoría de los demás grupos.
Ejemplos de afinidad electrónica de algunos elementos representativos
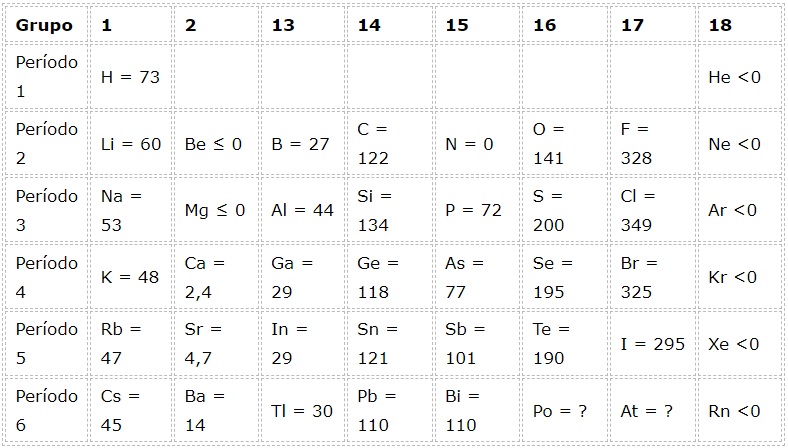
En la siguiente tabla se presentan los valores de afinidad electrónica en (kJ/mol) de los elementos representativos ordenados por grupo:
A continuación se presentan algunos ejemplos de afinidad electrónica junto con la reacción a la que hacen referencia:
1. Afinidad electrónica del hidrógeno
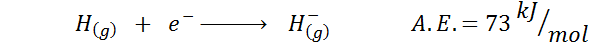
2. Afinidad electrónica del oxígeno
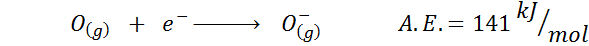
3. Afinidad electrónica de un anión
Otro ejemplo común es el caso de la afinidad electrónica de un anión tal como el O–. La A.E. en este caso viene dada por la energía asociada con el siguiente proceso:
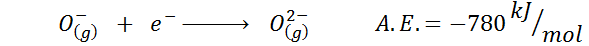
Como se puede observar, esta afinidad electrónica es fuertemente negativa, a pesar de que el ion O2- tiene la configuración electrónica del neón (un gas noble) y de ser un ion muy común en muchos sólidos iónicos.
La razón es que la repulsión de las cargas negativas en el O2- desestabiliza a dicho ion en estado gaseoso, pero en el estado sólido la carga es estabilizada por los cationes que lo rodean.
