Hormona del crecimiento (somatotropina): estructura, funciones
La somatotropina (STH) u hormona de crecimiento (GH por sus siglas en inglés) es una proteína relativamente pequeña producida a nivel de la adenohipófisis e involucrada en los procesos de desarrollo, crecimiento longitudinal del organismo y en el control de varios procesos metabólicos.
Se trata de una hormona no glandotropa. Las hormonas glandotropas de la hipófisis ejercen sus efectos a través de la modificación en la síntesis y liberación de otras hormonas producidas en otras glándulas endocrinas de la periferia del organismo.
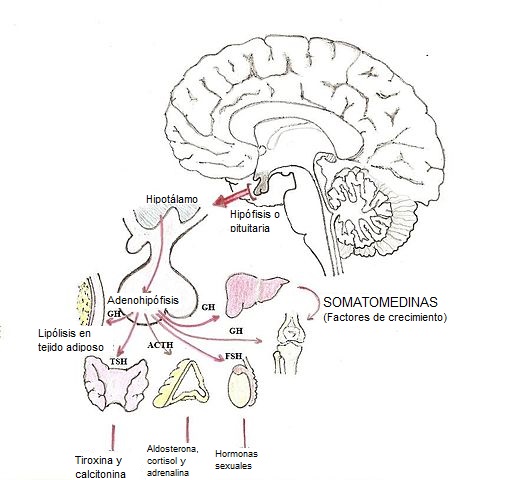
Hormonas glandotropas son, por ejemplo la adrenocorticotropina (ACTH), las gonadotropinas (FSH y LH) y la hormona estimulante del tiroides (TSH).
Las hormonas no glandotropas, por su parte, y entre las cuales se incluyen la prolactina y la hormona de crecimiento, actúan sin el concurso de cualquier otra glándula endocrina, ya que ejercen sus acciones de manera directa sobre las células blanco cuyas actividades regulan.
Índice del artículo
- 1 Estructura
- 2 Funciones
- 3 Receptores para la somatotropina
- 4 Producción
- 5 Liberación
- 6 Dosis
- 7 Efectos
- 8 Referencias
La hormona de crecimiento es una proteína relativamente pequeña que se presenta en varias isoformas. La isoforma principal está compuesta de unos 191 aminoácidos, tiene un peso molecular de 22 kDa y proviene de un péptido precursor más largo (pre-GH) de 28 kDa, que también se secreta pero que carece de funciones fisiológicas.
En su estructura, la somatotropina parece evolutivamente homóloga a la prolactina y a la somatomamotropina coriónica (CS), producida esta última en la placenta. Tal es la similitud, que se considera que las tres forman una familia hormonal.

La estructura secundaria de la somatotropina muestra 4 hélices alfa estabilizadas con dos puentes disulfuro, cuya configuración es necesaria para la interacción de la hormona con su receptor.
Un dato en relación con la estructura, y digno de ser resaltado, lo representa el hecho de que a pesar de que las hormonas de crecimiento de diferentes especies poseen remarcables similitudes con la humana, solo esta última, y la de los primates, ejercen efectos significativos en humanos.
Las funciones de la somatotropina usualmente se describen como aquellas asociadas al desarrollo y crecimiento del organismo. También las asociadas al metabolismo, que incluyen las modificaciones en el metabolismo lipídico y el de la glucosa promovidas por la hormona.
Las funciones de crecimiento, sin embargo, pueden también considerarse de tipo metabólico, puesto que implican funciones anabólicas asociadas a la síntesis de proteínas, lo cual no excluye algunas otras funciones sin asociación directa con el metabolismo como la proliferación celular.
Algunas de las funciones o acciones desplegadas por la somatotropina las ejerce esta hormona de manera directa sobre sus tejidos blancos, pero muchas de ellas son ejecutadas por algunas otras sustancias cuya síntesis y liberación son estimuladas por la hormona de crecimiento.
La primera línea de acción de la somatotropina es precisamente la síntesis de estas sustancias que se conocen como factores de crecimiento similares a la insulina (IGF), de los cuales se han identificado los tipos 1 y 2. Se designan como IGF1 (el más importante) e IGF2, de acuerdo con sus siglas en inglés.
Estos factores se conocieron inicialmente, y aún se siguen designando, como mediadores de la actividad de la somatotropina o somatomedinas C (IGF1) y A (IGF2) o también como actividad similar a la insulina no suprimible (NSILA). Son sintetizados por muchos tipos celulares, pero se producen fundamentalmente en el hígado.
Las acciones de la STH y del IGF1 son muy diversas. Algunas las ejercen cada una de estas sustancias de manera independiente, algunas veces en conjunción y de manera sinergística y algunas otras veces actúan antagónicamente.
Es esta una de las acciones más importantes promovidas por la somatotropina, pero ejecutada en conjunción con el IGF1. Aunque ambos inducen el crecimiento de numerosos tejidos corporales, su efecto más destacado se ejerce sobre el crecimiento del esqueleto.
Este resultado final se produce por varios efectos inducidos por la hormona y el IGF1. Incluyen el aumento del depósito de proteínas por las células condrocíticas y osteogénicas, la mayor tasa de reproducción de estas células y la conversión de condrocitos en células osteogénicas; todo lo cual conduce al depósito de hueso nuevo.
Durante el crecimiento y desarrollo del organismo, y antes del cierre de las epífisis óseas, se va depositando cartílago nuevo en las epífisis seguido de su conversión en hueso nuevo, con lo cual se alargan las diáfisis y se separan las epífisis.
El consumo progresivo de cartílago epifisario lo agota y el hueso no puede seguir creciendo. Al final de la adolescencia se funden entonces en cada extremo la diáfisis y la epífisis y el crecimiento en longitud de los huesos largos se enlentece y finalmente se detiene.
Un segundo mecanismo puede explicar el aumento en el grosor de los huesos. Los osteoblastos del periostio van depositando hueso nuevo sobre el viejo, y los osteoclastos van eliminando el hueso viejo. Si la tasa de deposición supera a la de eliminación el grosor aumenta.
Como la hormona de crecimiento ejerce una estimulación intensa sobre los osteoblastos, bajo sus efectos el grosor de los huesos puede seguir aumentando, aunque su longitud ya no se modifique debido al cierre de las epífisis.
Este efecto puede lograrse mediante distintos mecanismos: el aumento del transporte de aminoácidos a través de las membranas celulares, el aumento en la traducción de ARN a nivel de los ribosomas, el aumento en la transcripción del ADN a ARN en el núcleo y una reducción en el catabolismo proteico y de los aminoácidos.
En el tejido graso la hormona de crecimiento promueve la lipólisis y la liberación de ácidos grasos al torrente circulatorio, con lo cual aumenta su concentración en los líquidos corporales. Al mismo tiempo favorece en todos los tejidos la conversión de ácidos grasos en acetil coenzima A y su utilización como fuente de energía.
La estimulación de la utilización de las grasas, junto con la acumulación de proteínas por su efecto anabolizante, conducen a un incremento del tejido magro.
El incremento en la movilización de las grasas puede ser tan elevado que el hígado produce cantidades grandes de ácido acetoacético que conducen a cetosis y se puede generar un hígado graso.
En relación con el metabolismo de los hidratos de carbono, los efectos de la somatotropina incluyen la disminución de la captación de glucosa en tejido adiposo y muscular esquelético, aumento de la producción hepática de glucosa e incremento de la secreción de insulina.
Todos estos efectos se denominan diabetógenos, y una secreción elevada de hormona de crecimiento puede reproducir las alteraciones metabólicas que acompañan a la diabetes tipo II no insulinodependiente.
Las acciones anabólicas y mitógenas de la GH y el IGF1 se manifiestan también en el crecimiento y función del corazón, del hígado, del bazo, del tiroides, del timo y de la lengua. La hormona puede contribuir al engrosamiento de la piel, a la estimulación de las glándulas sudoríparas y al crecimiento del cabello.
En los riñones aumenta la tasa de filtración glomerular y la síntesis de calcitriol, con lo cual se favorece no solo el crecimiento, sino también la mineralización del hueso. Promueve también la eritropoyesis y la síntesis de fibrinógeno y la respuesta inmune por estimulación de los linfocitos T y los macrófagos.
Las acciones de la somatotropina, incluyendo la promoción de la síntesis de los factores de crecimiento similares a la insulina, son mediadas a través de su unión con receptores específicos expresados en las membranas de las células blanco.
Hay dos formas de estos receptores, la segunda de las cuales es una variante corta (truncada) de la primera; forma truncada que inhibe la función del receptor largo, y que de llegar a sobre-expresarse produciría una insensibilidad tisular a la hormona.
El receptor largo está formado por 638 aminoácidos y tiene un dominio extracelular de 250, una hélice alfa transmembranal de unos 38 y un dominio intracelular de 350 aminoácidos. Cada molécula de somatotropina termina uniéndose a dos moléculas de receptor y produciendo lo que se llama dimerización del receptor.
Esta dimerización activa unas proteín quinasas JAK2 ubicadas en los extremos intracelulares de cada monómero del receptor y estas quinasa activas fosforilan otros sustratos como el STAT5 y el propio receptor de la somatotropina.
Las moléculas de STAT5 fosforiladas sufren también una dimerización que las convierte en reguladores muy precisos de la expresión génica y la síntesis de proteínas.
La somatotropina es sintetizada a nivel de las células somatotropas de la adenohipófisis. Estas células se tiñen intensamente con sustancias ácidas por lo que se les denomina también acidófilas. Son en conjunto el grupo celular más abundante de la glándula ya que representan un 50% del total de 5 tipos distintos.
Existe un complejo genético de 5 genes en el brazo largo del cromosoma humano 17 que codifica para las distintas isoformas de la hormona de crecimiento y de la somatomamotropina coriónica humana (hCS).
Uno de ellos es el hGH-N o normal, que codifica la forma más abundante de hormona de crecimiento humana que es la citada de 22 kDa y representa el 75% del total de hormona de crecimiento circulante.
Su RNA mensajero se somete a “corte y empalme” para producir una forma más pequeña de la hormona, de 20 kDa, que carece de los residuos aminoácidos del 32 al 46 y representa el 10%.
Un segundo gen (hGH-V) se expresa principalmente en la placenta y codifica una forma variante de hGH de la cual solo aparecen cantidades significativas en la circulación durante el embarazo. Los otros 3 genes codifican isoformas de somatomamotropina coriónica humana.
Tanto la síntesis como la secreción o liberación de hormona de crecimiento están reguladas por factores estimuladores e inhibidores de dichas funciones.
Entre las principales influencias humorales estimuladoras de la síntesis y la secreción de somatotropina se cuentan los péptidos GHRH (hormona liberadora de la hormona de crecimiento) y Ghrelin.
La hormona liberadora de hormona de crecimiento (GHRH) es un péptido hipotalámico que existe en dos variantes de 40 y 44 aminoácidos respectivamente. Conduce en las células somatotropas a la síntesis de AMPc y a la activación del factor de transcripción PIT1 específico para la hormona de crecimiento.
Ghrelin es un secretagogo endógeno de hormona de crecimiento. Es un péptido de unos 28 aminoácidos sintetizado a nivel del hipotálamo y en el estómago. Actúa de manera sinergística con GHRH cuya liberación promueve, al mismo tiempo que inhibe la de somatostatina. Actúa a través de receptores que activan la fosfolipasa C.
Algunos parámetros metabólicos como la hipoglicemia, los bajos niveles de ácidos grasos libres en sangre y concentraciones elevadas de aminoácidos son estímulos importantes para la secreción de hormona de crecimiento.
Otros factores estimulantes que cuentan son el estrés agudo, la sobrecarga corporal, el dolor, los esteroides sexuales (pubertad), la dopamina, la estimulación de receptores α2, la acetilcolina, la galanina, la serotonina y la β-endorfina.
Entre estas se citan la somatostatina u hormona inhibidora de la liberación de hormona de crecimiento (GHRIH) y la retroalimentación negativa.
La somatostatina es un péptido hipotalámico de 14 aminoácidos que inhibe la secreción, pero no la síntesis, de la hormona de crecimiento. Una variante larga, de 28 aminoácidos, es sintetizada en el tracto gastrointestinal. Ambas variantes se unen al mismo receptor e inhiben la síntesis de AMP cíclico.
En cuanto a la retroalimentación negativa, la GH liberada, mediante una acción autocrina, inhibe su propia liberación ulterior. El IGF1 inhibe en el hipotálamo a la hormona liberadora de hormona de crecimiento y estimula a la somatostatina, mientras que inhibe en la hipófisis la síntesis de GH.
Algunos parámetros metabólicos como la hiperglucemia, los niveles plasmáticos elevados de ácidos grasos libres y los niveles bajos de aminoácidos son inhibidores de la secreción de somatotropina.
Inhibidores son también el frío, el estrés crónico, la adiposidad, la progesterona, los déficits de hormonas tiroideas, los déficits o los excesos de cortisol y la estimulación de receptores adrenérgicos β2.
El uso terapéutico de la hormona de crecimiento biosintetizada está indicado para el tratamiento de aquellos padecimientos en los cuales se ha puesto de manifiesto una deficiencia en su secreción, en el enanismo hipofisario y en niños de talla baja por el síndrome de Turner.
La administración se hace en forma de solución inyectable reconstruida a partir de un vial que contiene un liofilizado con 40 U.I. de la hormona biosintética, y al cual se le añaden los 2 ml acompañantes de solución de cloruro de sodio al 0,9 %.
En deficiencia de hormona de crecimiento en niños se recomienda entre 0,07 y 0,1 U.I./kg de peso corporal por día. En síndrome de Turner 0,14 U.I./kg de peso corporal por día. Para la deficiencia de hormona de crecimiento en adultos: 0,018 a 0,036 U.I./kg de peso corporal por día.
La administración terapéutica de la hormona de crecimiento puede ir acompañada de algunos efectos colaterales adversos como la hipersensibilidad manifiesta a través de urticaria generalizada, hipoglucemia de ayuno, inflamación en el sitio de la inyección y dolor de cabeza pasajero.
Se ha descrito el desarrollo de una cierta hipertensión intracraneal benigna, más frecuente en niños y menos en adultos.
En cuanto al metabolismo de los carbohidratos, se ha reportado el desarrollo de diabetes mellitus en pacientes que recibían tratamiento con la hormona de crecimiento.
En relación con el sistema músculo esquelético hay evidencias de miositis inflamatoria con mialgia y debilidad muscular, producidos no por la hormona, sino tal vez por el metacresol usado como conservador en la fórmula.
Se han reportado casos de ginecomastia, anemia y pancreatitis aguda.
- Ganong WF: The Pituitary Gland, 25th ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Pituitary Hormones and Their Control by the Hypothalamus, in Textbook of Medical Physiology, 13th ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormone, in Physiologie des Menschen mit Pathophysiologie, 31 th ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010
- Voigt K: Endokrines System, in Physiologie, 6th ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H and Strang KT: The Endocrine System. The Hypothalamus and Pituitary Gland, in Vander’s Human Physiology: The Mechanisms of Body Function, 13th ed; EP Windmaier et al (eds). New York, McGraw-Hill, 2014.
