Dimetilamina ((CH3)2NH): estructura, propiedades, usos, riesgos
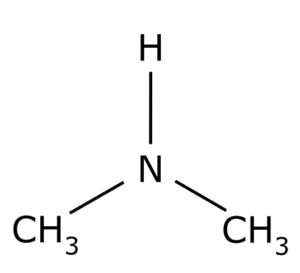
La dimetilamina es un compuesto orgánico formado por dos grupos metilo –CH3 unidos a un grupo –NH. Su fórmula química es (CH3)2NH. Es un gas incoloro. Cuando se encuentra en el aire a bajas concentraciones se percibe un olor a pescado. Sin embargo, si está en alta concentración tiene olor a amoníaco NH3.
La dimetilamina está presente en plantas y animales. Se cree que en el ser humano provenga de la descomposición de ciertas enzimas pero también de la ingestión de algunos alimentos como el pescado. Si se disuelve el gas de dimetilamina en agua, forma soluciones muy alcalinas y corrosivas.
Posee diversos usos industriales como por ejemplo para producir solventes, para acelerar la vulcanización de las gomas, para inhibir la corrosión de las tuberías, para fabricar jabones, para preparar colorantes y para absorber gases ácidos en ciertos procesos.
La dimetilamina es un gas muy inflamable. Los recipientes que la contienen no deben exponerse al calor o fuego pues pueden explotar. Además, sus vapores son irritantes de los ojos, la piel y el tracto respiratorio.
Es un compuesto que puede estar formando parte de aerosoles atmosféricos, es decir, de gotitas muy finas que se encuentran en la atmósfera.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Presencia en la naturaleza
- 6 Usos
- 7 Riesgos
- 8 Influencia de la DMA en la atmósfera
- 9 Referencias
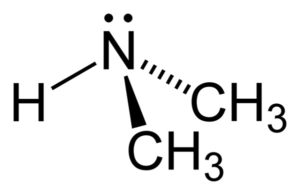
La dimetilamina es una amina alifática secundaria. Esto significa que los sustituyentes del nitrógeno (N) son alifáticos (–CH3), lo que significa que no son aromáticos, y que son dos. Por lo tanto son dos metilos –CH3 unidos al nitrógeno, el cual tiene además un hidrógeno (H).
En la molécula de dimetilamina el nitrógeno (N) posee un par de electrones libres, es decir, un par de electrones que no están unidos a ningún otro átomo.
– Dimetilamina
– N,N-Dimetilamina
– N-metilmetanamina
– DMA (siglas de Di-Metil-Amina).
Gas incoloro.
45,08 g/mol
-93 ºC
7,3 ºC
-6,69 ºC (método de copa cerrada).
400 °C
Líquido = 0,6804 g/cm3 a 0 ºC.
Vapor = 1,6 (densidad relativa con respecto al aire, aire=1).
Muy soluble en agua: 163 g/100 g de agua a 40 °C. Soluble en etanol y éter etílico.
Las soluciones acuosas de dimetilamina son fuertemente alcalinas.
Kb = 5,4 x 10-4
pKa del ácido conjugado = 10,732 a 25 °C. El ácido conjugado es el ion dimetilamonio: (CH3)NH2+
La dimetilamina líquida puede atacar algunos plásticos, gomas y recubrimientos.
Al disolverse en agua, el par de electrones libres del nitrógeno (N) toma un protón (H+) del agua, dejando libre un OH–, por lo que forma soluciones muy alcalinas y corrosivas:
Dimetilamina + Agua → Ion Dimetilamonio + Ion Hidroxilo
(CH3)2NH + H2O → (CH3)2NH2+ + OH–
Con ácido nítrico se obtiene una sal de nitrato, es decir, el nitrato de dimetilamonio:
Dimetilamina + Ácido Nítrico → Nitrato de Dimetilamonio
(CH3)2NH +HNO3 → (CH3)2NH2+NO3–
Cuando se encuentra en baja concentración en el aire tiene un olor similar al pescado, mientras que en altas concentraciones huele a amoníaco (NH3).
En el organismo, la dimetilamina puede sufrir nitrosación bajo condiciones débilmente ácidas para dar dimetilnitrosamina un compuesto carcinógeno (CH3)2N-NO.
La formación de dimetlnitrosamina ocurre a partir de dimetilamina y nitrito (nitrito de sodio) en el estómago (a pH 5-6) por acción de las bacterias existentes en el tracto gastrointestinal. El nitrito de sodio está presente en algunos alimentos.
Dimetilamina + Nitrito de sodio → Dimetilnitrosamina + Hidróxido de sodio
(CH3)2NH + NaNO2 → (CH3)2N-NO + NaOH
La dimetilamina se prepara comercialmente haciendo reaccionar metanol (CH3OH) con amoníaco (NH3) a 350-450 °C en presencia de un catalizador de sílice-alúmina (SiO2/Al2O3).
2 CH3OH + NH3 → (CH3)2NH + 2 H2O
Dado que se producen también la monometilamina y la trimetilamina, se realiza una purificación en una serie de cuatro a cinco columnas de destilación.
La dimetilamina se encuentra en plantas y animales. Además está presente de forma natural y abundante en la orina humana.
Se estima que su presencia en humanos se debe a que la producen ciertos tipos de bacterias intestinales a partir de algunos compuestos que se encuentran en los alimentos.
Algunos de estos compuestos son la colina (compuesto que se asocia con el grupo de vitaminas B) y el óxido de trimetilamina. También se cree que provenga de una enzima inhibidora del óxido nítrico (NO) que se forma en el organismo.
Ciertas fuentes de información indican que el aumento de dimetilamina en la orina es causado por la ingestión de pescado y frutos del mar, donde los valores mayores se obtienen cuando se comen calamares, merluza, sardinas, pez espada, bacalao, pescadilla y raya.

Se considera que a dimetilamina es una toxina urémica, esto es, una sustancia que puede causar daño si se eleva mucho su concentración en la orina. De hecho se han observado niveles muy altos de dimetilamina en pacientes con enfermedad renal en etapa terminal.
Se cree que en estos pacientes puede haber sobrepoblación de bacterias intestinales que podrían estarla produciendo.
La dimetilamina o DMA se utiliza para:
– Preparación de otros compuestos.
– Producción de los solventes dimetilformamida y dimetilacetamida.
– Acelerar la vulcanización de ciertas gomas.
– Eliminar el pelo de las pieles durante el curtido.
– Actuar como antioxidante para solventes.
– Servir como agente de flotación de minerales.
– Inhibir la corrosión y como agente antiincrustaciones de tuberías.
– Funcionar como surfactante.
– Fabricar jabones y detergentes.
– Actuar como químico en textiles.
– Funcionar como agente antidetonante en combustibles y como estabilizador de la gasolina.
– Preparar colorantes.
– Absorber gases ácidos.
– Servir como propulsor de pesticidas y cohetes.
– Formar parte de agentes para tratamiento de aguas.
– Actuar como fungicida en productos agroquímicos.
– Usos ya descontinuados como atraer y exterminar gorgojos o insectos que atacan el algodón.


Los vapores de dimetilamina son irritantes de la piel, de los ojos y del tracto respiratorio.
Si entra en contacto con la piel en forma líquida puede producir congelación y quemadura de tipo químico. Su inhalación tiene efectos adversos a la salud.
El gas de DMA es corrosivo y puede formar soluciones acuosas corrosivas. Sus soluciones acuosas pueden llegar a ser inflamables a menos que estén bastante diluidas.
La dimetilamina en forma de gas se inflama fácilmente produciendo humos tóxicos de óxidos de nitrógeno (NOx).
Si el recipiente que contiene este gas se expone a fuego o calor intenso, puede explotar.
El aerosol atmosférico (gotitas muy pequeñas de mezcla de compuestos naturales y/o contaminantes en la atmósfera) tiene un impacto profundo en el clima global y en la calidad del aire en las diversas regiones del mundo.
La formación de las nuevas partículas de aerosol todavía no es comprendida completamente.
Se estima que la dimetilamina participa junto con otros compuestos en la formación de estas partículas, lo que parece depender de que en la zona haya fuertes emisiones de DMA.
Por ejemplo en las zonas industriales hay mayor concentración que en las zonas agrícolas, y esto puede influir en la forma en que la DMA participe.
Es de notar que, según algunos científicos, la quema de material vegetal que contiene glifosato (uno de los herbicidas que más se utilizan en el mundo), puede conducir a la formación de dimetilamina.
- U.S. National Library of Medicine. (2019). Dimethylamine. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fourth Edition. John Wiley & Sons.
- Morrison, R.T. and Boyd, R.N. (2002). Organic Chemistry. 6th Edition. Prentice-Hall.
- Windholz, M. et al. (editors) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals. Tenth Edition. Merck & CO., Inc.
- Abramowitz, M.K. et al. (2010). The Pathophysiology of Uremia. Aliphatic Amines. In Chronic Kidney Disease, Dialysis, and Transplantation (Third Edition). Recuperado de sciencedirect.com.
- Li, H. et al. (2019). Influence of atmospheric conditions on sulfuric acid-dimethylamine-ammonia-based new particle formation. Chemosphere 2019; 245:125554. Recuperado de ncbi.nlm.nih.gov.
- Mackie, J.C. and Kennedy, E.M. (2019). Pyrolysis of Glyphosate and Its Toxic Products. Environ. Sci. Technol. 2019: 53(23):13742-13747. Recuperado de ncbi.nlm.nih.gov.
