Modelo corpuscular de la materia: explicación, origen y fundamentos
¿Qué es el modelo corpuscular de la materia?
El modelo corpuscular de la materia es un modelo de la estructura microscópica de la materia, que busca explicar las propiedades y comportamiento en cada estado de agregación.
El postulado fundamental del modelo es que la materia está conformada por pequeñas partículas, que pueden ser átomos, iones o moléculas, siempre en continua agitación.
En este modelo se aplican las leyes de la mecánica clásica a las partículas, si bien por el gran número presente, no se estudian individualmente sino mediante un tratamiento estadístico. De esta manera se obtienen los valores promedio de las magnitudes macroscópicas de interés, como presión, temperatura y volumen.
El modelo corpuscular explica asimismo propiedades como viscosidad, dureza, flexibilidad y densidad de los materiales, así como la dilatación térmica, entre otros fenómenos.
Orígenes del modelo corpuscular de la materia
Las ideas sobre la naturaleza corpuscular de la materia datan por lo menos del siglo V a.C. En la antigua Grecia, Leucipo (450 a. C. – 370 a. C.) y Demócrito (460 al 370 a C), discípulo de aquel, habían especulado acerca de la organización de la materia a nivel microscópico.
Estos filósofos propusieron que la materia está compuesta por diminutas partículas indivisibles, nombradas átomos, una palabra de raíz griega que significa precisamente “indivisible”.
La teoría fue descartada por Aristóteles, el sabio más influyente de su tiempo. Sin embargo, no fue sino hasta el siglo XVII que la teoría corpuscular comenzó a tomar relevancia de nuevo, y en el siglo XIX, los secretos de la materia por fin empezaron a desvelarse.
En 1803 el químico inglés John Dalton (1766-1844) propuso nuevamente que la materia estaba formada por corpúsculos llamados átomos, que se combinaban en determinadas proporciones para formar las moléculas de una sustancia.
Los átomos de Dalton eran indivisibles, pero pronto se desarrolló una sólida estructura teórica, sobre todo gracias a James C. Maxwell (1831-1979) y Ludwig Boltzmann (1844-1906). Así se establecieron los cimientos de la mecánica estadística y la física del estado sólido.
Fundamentos del modelo corpuscular de la materia
Los principales postulados del modelo son:
- La materia, sin importar su estado de agregación, está formada por partículas microscópicas, que pueden ser átomos individuales o en combinación, para formar moléculas.
- Las distintas sustancias difieren entre sí debido a que están constituidas por partículas diferentes.
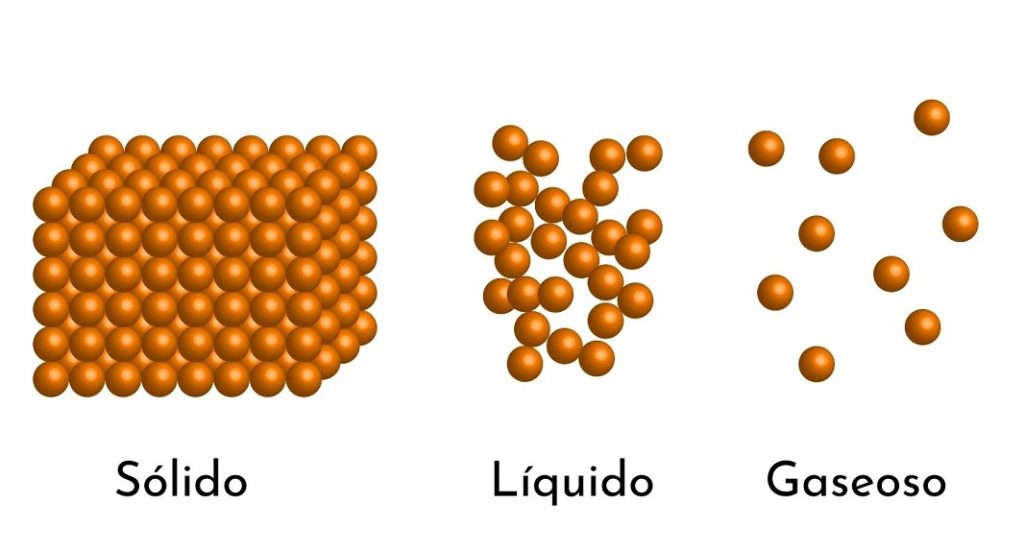
- De acuerdo al estado de agregación de la materia, existen espacios vacíos entre las partículas, más grandes en los gases y más pequeños en los sólidos.
- Las partículas que constituyen la materia están en perpetua agitación. A mayor agitación, mayor energía cinética poseen, y si se añade calor, el movimiento de las partículas se incrementa.
- Asimismo, en líquidos y sólidos, las partículas experimentan atracción de distinta intensidad, debido a fuerzas intermoleculares. En los gases, las moléculas están muy separadas y se mueven rápidamente, por lo que estas fuerzas no tienen mayor incidencia. Pero en los líquidos, cuyas partículas tienen más cohesión, estas fuerzas son más intensas, y en los sólidos es aún mayor.
Teoría cinética de los gases
El modelo corpuscular se aplicó primero a los gases, por ser el estado de agregación más sencillo y las fuerzas de cohesión entre las moléculas son mínimas. Además, las propiedades de los gases eran bien conocidas a través de los trabajos experimentales del químico inglés Robert Boyle y de los franceses Joseph Gay Lussac y Jacques Charles.
El modelo de los gases ideales, el más simple, contempla que:
- El tamaño de las partículas es muchísimo menor que las distancias entre ellas, y que las dimensiones del contenedor. Son masas puntuales, es decir, carentes de dimensiones y no ocupan un volumen.
- Las partículas se encuentran en agitación permanente, siendo su movimiento únicamente de traslación.
- Ocasionalmente las partículas chocan elásticamente, entre sí y con las paredes del recipiente. En los choques totalmente elásticos la energía cinética se conserva.
- No existen fuerzas atractivas entre las moléculas. Las únicas interacciones se deben a las colisiones que ocurren de vez en cuando y por un tiempo muy breve. Del resto, cada molécula actúa independientemente de las demás.
- Si no hay fuerzas externas actuando sobre el sistema de partículas, estas se distribuyen de manera uniforme por todo el volumen disponible.
Aunque este es el modelo más simple, explica bien el comportamiento de cualquier gas poco denso a altas temperaturas y bajas presiones. Los científicos han desarrollado otros modelos mejor ajustados al comportamiento de los gases reales, para ello consideran que:
- Las moléculas tienen un tamaño mensurable.
- No se anulan las fuerzas intermoleculares.
Ecuación del gas ideal
Gracias a los postulados del gas ideal, surge una expresión que relaciona las magnitudes macroscópicas de la presión P, el volumen V y la temperatura T:
P∙V = nRT
Donde n es el número de moles de gas y R es la constante universal de los gases, cuyo valor en unidades del Sistema Internacional es 8.314 J/mol∙K.
Energía cinética y temperatura
En un gas ideal, toda la energía interna se manifiesta como energía cinética. La energía cinética media K de las n moléculas de un gas ideal es directamente proporcional a su temperatura en kelvin:
Modelo corpuscular en líquidos y sólidos
En realidad, toda la materia puede encontrarse en los tres estados más sencillos: como gas, líquido o sólido, según la presión y la temperatura. Hay otros estados de agregación como el plasma, pero no cerca de la superficie de la Tierra.
Estos estados se deben a la manera en que actúan las fuerzas de atracción intermoleculares, que son de corto alcance, es decir, no actúan si la distancia entre moléculas es muy grande y las partículas se mueven a gran velocidad. Es el caso de los gases, lo que permite que ocurra el fenómeno de la difusión con mayor rapidez. Ello explica que al destapar un perfume el aroma se extienda rápidamente.
En cambio, cuando las partículas están más cercanas y su movimiento es más lento, como en líquidos y sólidos, estas fuerzas intermoleculares tienen la oportunidad de ejercer su acción.
Así, cuando un gas pasa al estado líquido disminuye su volumen, porque la distancia entre sus partículas disminuye, y todavía más cuando pasa a ser sólido.
Materia en estado líquido
En el estado líquido, las fuerzas intermoleculares no son despreciables, pero actúan a menor escala que en el estado sólido. Las partículas forman pequeños grupos, que se disgregan y reagrupan continuamente, brindándole movilidad al material, aunque manteniendo un volumen fijo.
Esta movilidad permite que los líquidos se adapten a la forma del recipiente y les otorga la capacidad de fluir, además de poder mezclarse con más facilidad. La difusión puede ocurrir, pero con más lentitud que en los gases.
Aún así, las partículas tienen suficiente cohesión como para que el líquido se mantenga incompresible en un amplio rango de temperaturas.
Tensión superficial
En la superficie del líquido quedan moléculas sobre las que actúan fuerzas intermoleculares no equilibradas, dando lugar a una fuerza neta hacia arriba. Esta fuerza neta se minimiza cuando el líquido presenta la menor superficie posible.
Gracias a esta fuerza, alfileres, clips, insectos y otros objetos pequeños consiguen mantenerse sobre la superficie quieta del agua sin hundirse.

Materia en estado sólido
En el estado sólido las partículas están muy próximas entre sí, y las fuerzas intermoleculares hacen que las partículas se queden en posiciones fijas. Aunque pueden vibrar alrededor de esta posición, los sólidos adoptan una forma definida y mantienen su volumen constante.
Al fluir el calor, la amplitud del movimiento vibratorio aumenta y la temperatura se incrementa. Esto ocasiona que las dimensiones del cuerpo aumenten con la temperatura, un fenómeno llamado dilatación térmica. Si fluye suficiente calor, el sólido incluso puede pasar a la fase líquida.
