Nitrilos: propiedades, nomenclatura, usos, ejemplos
Los nitrilos son todos aquellos compuestos orgánicos que poseen el grupo funcional CN, al cual se le denomina también como grupo ciano, o cianuro en lo que respecta a la química inorgánica. Los nitrilos alifáticos se representan con la fórmula general RCN, mientras los nitrilos aromáticos con la fórmula ArCN.
A pesar de que el cianuro de hidrógeno, HCN, y así como las sales metálicas de cianuro son compuestos altamente tóxicos, no sucede exactamente lo mismo con los nitrilos. El grupo CN en un esqueleto carbonado de cualquier tipo (ramificado, lineal, aromático, etc.), se comporta diagonalmente distinto a un anión cianuro, CN–.
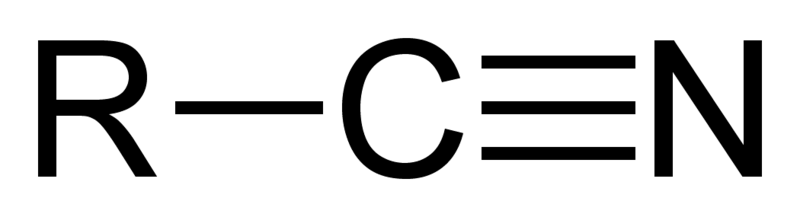
Los nitrilos se encuentran muy diseminados en el mundo de los plásticos, pues varios de ellos derivan del acrilonitrilo, CH2CHCN, un nitrilo con el cual se sintetizan polímeros como los cauchos de nitrilo, usados para fabricar guantes de cirugía o de laboratorio. Asimismo, los nitrilos están presentes en muchos productos naturales y farmacéuticos.
Por otro lado, los nitrilos son precursores de los ácidos carboxílicos, ya que sus hidrólisis representan un método alternativo de síntesis para obtener a estos últimos.
Índice del artículo
Las estructuras moleculares de los nitrilos varían en función de la identidad de R o Ar en los compuestos RCN o ArCN, respectivamente.
No obstante, la geometría del grupo CN es lineal debido a su triple enlace, C≡N, el cual es producto de la hibridación sp. Así, los átomos C-C≡N se sitúan en una misma línea. Más allá de estos átomos, puede haber cualquier tipo de estructura.
Los nitrilos son compuestos polares, ya que el nitrógeno del grupo CN es muy electronegativo y atrae los electrones hacia sí. Por lo tanto, tienen puntos de fusión o ebullición más altos que sus homólogos alcanos.
Por ejemplo, el acetonitrilo, CH3CN, es un líquido que hierve a 82 ºC; mientras que el etano, CH3CH3, es un gas que hierve a -89 ºC. Nótese pues el gran efecto que tiene el grupo CN sobre las interacciones intermoleculares.
El mismo razonamiento aplica para compuestos de mayor envergadura: si tienen uno o más grupos CN en su estructura, es bastante probable que su polaridad se incremente y sean más afín a superficies o líquidos polares.
Podría pensarse que debido a la alta polaridad de los nitrilos, estos sean bases relativamente fuertes frente a las aminas. Sin embargo, hay que considerar los enlaces covalentes C≡N, y el hecho de que tanto el carbono como el hidrógeno tienen hibridación sp.
La basicidad del RCN: se representa mediante la aceptación de un protón proveniente, de ordinario, del agua:
RCN: + H2O ⇌ RCNH+ + OH–
Para que se protone el RCN: el par libre de electrones sobre el nitrógeno debe formar un enlace con el ion H+. Pero hay un inconveniente: la hibridación sp del nitrógeno lo vuelve demasiado electronegativo, tanto que atrae muy fuertemente este par de electrones y ni siquiera permite que logre formar un enlace.
Por lo tanto, se dice que el par de electrones del nitrógeno sp no está disponible, y que la basicidad de los nitrilos es muy baja. Los nitrilos de hecho son millones de veces menos básicos que las aminas.
Entre las reacciones más representativas de los nitrilos tenemos su hidrólisis y reducción. Estas hidrólisis son mediadas por la acidez o basicidad del medio acuoso, originando un ácido carboxílico o una sal de carboxilato, respectivamente:
RCN + 2H2O + HCl → RCOOH + NH4Cl
RCN + H2O + NaOH → RCOONa + NH3
En el proceso se forma además una amida.
Los nitrilos se reducen a aminas utilizando hidrógeno y catalizadores metálicos:
RCN → RCH2NH2
De acuerdo a la nomenclatura IUPAC, los nitrilos se nombran añadiendo el sufijo -nitrilo al nombre de la cadena del alcano del cual deriva, incluyendo también el carbono del grupo ciano. Así, el CH3CN se llama etanonitrilo, y el CH3CH2CH2CN, butanonitrilo.
Asimismo, pueden nombrarse partiendo del nombre del ácido carboxílico, al cual se le elimina la palabra ‘ácido’, y se sustituyen los sufijos -ico u –oico por el sufijo -onitrilo. Por ejemplo, para el CH3CN sería acetonitrilo (de ácido acético); para el C6H5CN, sería benzonitrilo (de ácido benzoico); y para el (CH3)2CHCN, 2-metilpropanonitrilo.
Alternativamente, si se consideran los nombres de los sustituyentes alquílicos, los nitrilos podrán mencionarse utilizando la palabra ‘cianuro’. Por ejemplo, el CH3CN se llamaría entonces cianuro de metilo, y el (CH3)2CHCN, cianuro de isopropilo.
Los nitrilos forman parte de los productos naturales, encontrándose en las almendras amargas, en los huesos de diversas frutas, en animales marinos, plantas y bacterias.
Sus grupos CN componen las estructuras de lípidos y glucósidos cianogénicos, biomoléculas que al degradarse liberan cianuro de hidrógeno, HCN, un gas altamente venenoso. Por lo tanto, tienen un inminente uso biológico para determinadas criaturas.
Se dijo anteriormente que los grupos CN confieren mucha polaridad a las moléculas, y de hecho no pasan desapercibidos cuando están presentes en compuestos con actividad farmacológica. Tales medicamentos de nitrilo se han usado para combatir la hiperglicemia, el cáncer de senos, la diabetes, la psicosis, la depresión y otros trastornos.
Además de tener un papel en la biología y medicina, industrialmente conforman un puñado de plásticos de nitrilos, con los cuales se elaboran guantes quirúrgicos y de laboratorio, sellos de piezas automotrices, mangueras y juntas debido a su resistencia contra la corrosión y las grasas, materiales como los tupperware, instrumentos musicales o bloques de Legos.
A continuación y para finalizar se enlistarán algunos ejemplos de nitrilos.
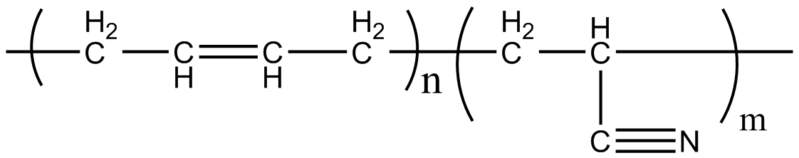
El caucho de nitrilo, con el que se fabrican los guantes ya mencionados y materiales resistentes a las grasas, es un copolímero formado por acrilonitrilo y butadieno (arriba). Nótese lo lineal que luce el grupo CN.
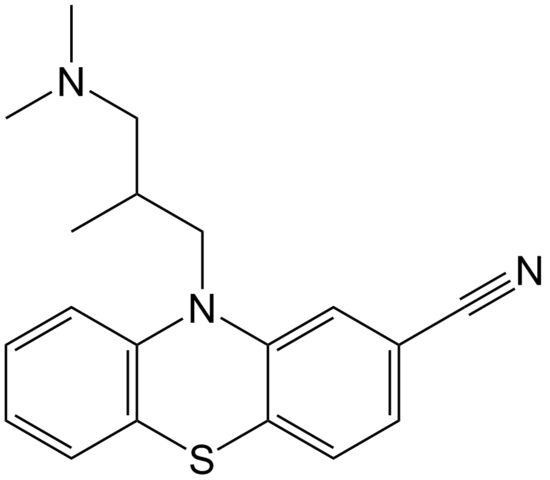
La ciamemazina es un ejemplo de un nitrilo en el área de la farmacia que se utiliza como antipsicótico, específicamente para tratar los trastornos de la ansiedad y la esquizofrenia. Nuevamente, nótese la linealidad del grupo CN.
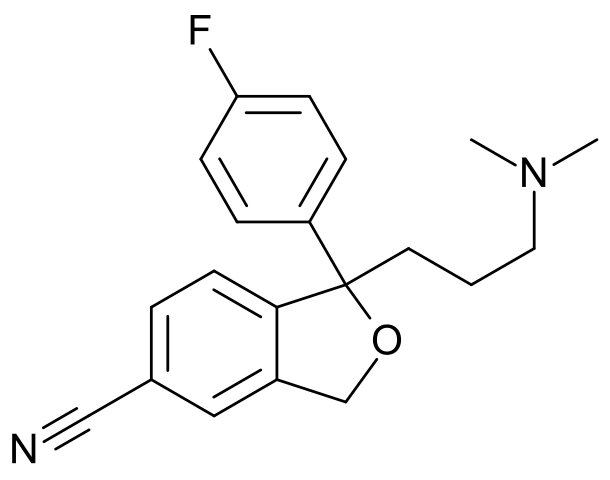
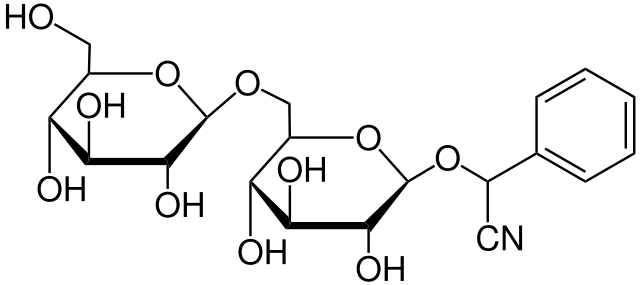
La amigdalina es un ejemplo de un glucósido cianogénico. Se encuentra en almendras amargas, ciruelas, albaricoques y duraznos. Nótese lo pequeño que luce el grupo CN respecto al resto de la estructura; aun así, su sola presencia basta para dotar de una identidad química única a este carbohidrato.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Nitrile. Recuperado de: en.wikipedia.org
- Chemistry LibreTexts. (05 de junio de 2019). Chemistry of Nitriles. Recuperado de: chem.libretexts.org
- Jim Clark. (2016). Hydrolysing nitriles. Recuperado de: chemguide.co.uk
- Ivy Rose Holistic. (2020). Naming nitriles. Recuperado de: ivyroses.com
- Germán Fernández. (s.f.). Nomenclatura de Nitrilos: Reglas IUPAC. Recuperado de: quimicaorganica.org
