Flúor: historia, propiedades, estructura, obtención, riesgos, usos
El flúor es un elemento químico que se representa con el símbolo F y encabeza el grupo 17, al cual pertenecen los halógenos. Se distingue por encima de los otros elementos de la tabla periódica, por ser el más reactivo y electronegativo; reacciona casi con todos los átomos, por lo que forma infinidad de sales y compuestos organofluorados.
En condiciones normales es un gas de color amarillo pálido, el cual puede confundirse con el verde amarillento. En estado líquido, mostrado en la imagen inferior, se intensifica un poco más su color amarillo, el cual desaparece por completo cuando solidifica en su punto de congelación.

Es tal su reactividad, a pesar de lo volátil de su gas, que permanece atrapado en la corteza terrestre; especialmente en forma de mineral fluorita, conocido por sus cristales violetas. Asimismo, su reactividad lo vuelve una sustancia potencialmente peligrosa; reacciona vigorosamente con todo lo que toca y arde en llamas.
No obstante, muchos de sus productos derivados pueden ser inofensivos e inclusive beneficiosos, dependiendo de sus aplicaciones. Por ejemplo, el uso más popular del flúor, adicionado en su forma iónica o mineral (como sales de fluoruro), consiste en la preparación de pastas dentales con flúor, las cuales ayudan a proteger el esmalte dental.
El flúor presenta la particularidad de que puede estabilizar los altos números o estados de oxidación para muchos otros elementos. Mientras mayor sea el número de átomos de flúor, más reactivo será el compuesto (a menos que se trate de un polímero). Igualmente, sus efectos con las matrices moleculares aumentarán; para bien o para mal.
Índice del artículo
- 1 Historia
- 2 Propiedades físicas y químicas
- 2.1 Apariencia
- 2.2 Número atómico (Z)
- 2.3 Peso atómico
- 2.4 Punto de fusión
- 2.5 Punto de ebullición
- 2.6 Densidad
- 2.7 Calor de vaporización
- 2.8 Capacidad calórica molar
- 2.9 Presión de vapor
- 2.10 Conductividad térmica
- 2.11 Orden magnético
- 2.12 Olor
- 2.13 Números de oxidación
- 2.14 Energía de ionización
- 2.15 Electronegatividad
- 2.16 Agente oxidante
- 2.17 Reactividad
- 3 Estructura y configuración electrónica
- 4 Dónde se encuentra y obtención
- 5 Isótopos
- 6 Papel biológico
- 7 Riesgos
- 8 Usos
- 9 Referencias
En 1530, el mineralogista alemán Georgius Agricola descubrió que el mineral fluorspar podía usarse en la purificación de metales. El fluorspar es otro nombre para la fluorita, un mineral de flúor que consistía en fluoruro de calcio (CaF2).
El elemento flúor no se había descubierto para entonces y el “fluoir” en la fluorita provenía de la palabra latina “fluere” que significa “fluir”; ya que, esto era lo que precisamente hacía el fluorspar o fluorita con los metales: ayudaba a que se fueran de la muestra.
En 1764, Andreas Sigismud Margraff logró preparar ácido fluorhídrico, calentando fluorita con ácido sulfúrico. Las retortas de vidrio se fundieron por la acción del ácido, por lo que se sustituyó el vidrio por metales.
También se atribuye a Carl Scheele en 1771, la preparación del ácido por el mismo método seguido por Margraff. En 1809, el científico francés Andre-Marie Ampere propuso que el ácido flúorico o fluorhídrico era un compuesto formado por hidrógeno y un nuevo elemento similar al cloro.
Los científicos trataron de aislar el flúor mediante el uso del ácido fluorhídrico durante mucho tiempo; pero su peligrosidad hizo difícil el avance en este sentido.
Humphry Davy, Joseph Louis Gay-Lussac y Jacques Thénard tuvieron fuertes dolores al inhalar el fluoruro de hidrógeno (ácido fluorhídrico sin agua y en forma gaseosa). En circunstancias similares murieron por envenenamiento los científicos Paulin Louyet y Jerome Nickles.
Edmond Frémy, investigador francés, trató de crear el ácido fluorhídrico seco para evitar la toxicidad del fluoruro de hidrógeno mediante la acidificación del bifluoruro de potasio (KHF2), pero durante la electrólisis no hubo conducción de la corriente eléctrica.
En 1860, el químico inglés George Gore intentó realizar la electrólisis del ácido fluorhídrico seco y logró aislar una pequeña cantidad del gas flúor. Sin embargo, se produjo una explosión al recombinarse violentamente el hidrógeno con el flúor. Gore atribuyó la explosión a una fuga de oxígeno.
En 1886, el químico francés Henri Moisson logró aislar el flúor por vez primera. Previamente, el trabajo de Moisson fue interrumpido cuatro veces por envenenamiento grave con fluoruro de hidrógeno, mientras intentaba el aislamiento del elemento.
Moisson fue alumno de Frémy y se basó en sus experimentos para aislar el flúor. Moisson utilizó en la electrólisis una mezcla de fluoruro de potasio y ácido fluorhídrico. La solución resultante condujo la electricidad y el gas flúor se acumuló en el ánodo; es decir, en el electrodo cargado positivamente.
Moisson usó un equipo resistente a la corrosión, en el cual los electrodos estaban hechos de una aleación de platino e iridio. En la electrólisis utilizó un recipiente de platino y enfrió la solución electrolítica a una temperatura de -23 ºF (-31 ºC).
Finalmente, el 26 de junio de 1886, Henri Moissson logró aislar el flúor, trabajo que le permitió ganar el Premio Nobel en 1906.
Durante un tiempo se perdió interés por la investigación con flúor. No obstante, el desarrollo del Proyecto Manhattan para la producción de la bomba atómica, volvió a impulsarlo.
La compañía estadounidense Dupont desarrolló, entre los años 1930 y 1940, productos fluorados como los clorofluorocarbonados (Freon-12), usados como refrigerantes; y el plástico politetrafluoroetileno, conocido mejor con el nombre teflon. Esto produjo un incremento en la producción y consumo del flúor.
En 1986, en una conferencia por cumplirse un siglo del aislamiento del flúor, el químico estadounidense Karl O. Christe presentó un método químico para la preparación de flúor mediante la reacción entre K2MnF6 y el SbF5.
El flúor es un gas amarillo pálido. En estado líquido es amarillo brillante. Mientras, el sólido puede ser opaco (alfa) o transparente (beta).
9.
18,998 u.
-219,67 ºC.
-188,11 ºC.
A temperatura ambiente: 1,696 g/L.
En el punto de fusión (líquido): 1,505 g/mL.
6,51 kJ/mol.
31 J/(mol·K).
A una temperatura de 58 K tiene una presión de vapor de 986,92 atm.
0,0277 W/(m·K)
Diamagnética
Olor característico picante y penetrante, detectable inclusive a 20 ppb.
-1, el cual corresponde al anión fluoruro, F–.
-Primera: 1.681 kJ/mol
-Segunda: 3.374 kJ/mol
-Tercera: 6.147 KJ/mol
3,98 en la escala de Pauling.
Es el elemento químico con la mayor de las electronegatividades; es decir, tiene una alta afinidad por los electrones de los átomos con los que se enlaza. Debido a esto, los átomos de flúor generan momentos dipolares grandes en regiones específicas de una molécula.
Su electronegatividad también tiene otro efecto: los átomos enlazados a él pierden tanta densidad electrónica que comienzan a adquirir una carga positiva; esta es, un número de oxidación positivo. Mientras más átomos de flúor haya en un compuesto, el átomo central tendrá un número de oxidación más positivo.
Por ejemplo, en el OF2 el oxígeno tiene un número de oxidación de +2 (O2+F2–); en el UF6, el uranio tiene un número de oxidación de +6 (U6+F6–); lo mismo sucede con el azufre en el SF6 (S6+F6–); y finalmente está el AgF2, en donde la plata incluso tiene un número de oxidación de +2, poco común en él.
Por lo tanto, los elementos logran participar con sus números de oxidación más positivos cuando forman compuestos con el flúor.
El flúor es el elemento oxidante más potente, por lo que ninguna sustancia es capaz de oxidarlo; y por esta razón, no se encuentra libre en la naturaleza.
El flúor es capaz de combinarse con todos los demás elementos, excepto con el helio, neón y argón. No ataca además al acero dulce ni al cobre a temperaturas normales. Reacciona de forma violenta con los materiales orgánicos, tales como el caucho, la madera y la tela.
El flúor puede reaccionar con el gas noble xenón para formar el oxidante fuerte difluoruro de xenón, XeF2. También reacciona con el hidrógeno para formar un haluro, el fluoruro de hidrógeno, HF. A su vez, el fluoruro de hidrógeno se disuelve en el agua para producir el famoso ácido fluorhídrico (come vidrio).
La acidez de los ácidos hidrácidos, clasificados en orden creciente es:
HF HCl HBr HI
El ácido nítrico reacciona con el flúor para formar nitrato de flúor, FNO3. Mientras, el ácido clorhídrico reacciona vigorosamente con el flúor para formar HF, OF2 y ClF3.


El átomo de flúor en su estado basal tiene siete electrones de valencia, los cuales están en los orbitales 2s y 2p de acuerdo a la configuración electrónica:
[He] 2s2 2p5
La teoría del enlace de valencia (TEV) establece que dos átomos de flúor, F, se enlazan covalentemente para poder completar cada uno su octeto de valencia.
Esto ocurre rápidamente porque apenas le falta un electrón para volverse isoelectrónico al gas noble neón; y sus átomos son muy pequeños, con una carga nuclear efectiva muy fuerte que demanda fácilmente electrones del entorno.
La molécula F2 (imagen superior), tiene un enlace covalente simple, F-F. A pesar de su estabilidad en comparación a los átomos F libres, es una molécula sumamente reactiva; homonuclear, apolar, y ávida por electrones. Es por eso que el flúor, como F2, es una especie muy tóxica y peligrosa.
Debido a que el F2 es apolar, sus interacciones dependen de su masa molecular y las fuerzas de dispersión de London. En algún momento, la nube electrónica entorno a ambos átomos F debe deformarse y originar un dipolo instantáneo que induzca otro en una molécula vecina; para que así, se atraigan lenta y débilmente.
La molécula F2 es muy pequeña y se difunde en el espacio con relativa rapidez. En su fase gaseosa, exhibe un color amarillo pálido (que puede confundirse con un verde lima). Cuando la temperatura desciende hasta los -188 ºC, las fuerzas de dispersión se vuelven más efectivas y logran que las moléculas F2 cohesionen lo suficiente para definir un líquido.
El flúor líquido (primera imagen), luce aún más amarillo que su respectivo gas. En él, las moléculas F2 se hallan más cercanas e interaccionan con la luz en un mayor grado. Curiosamente, una vez se forme el cristal cúbico distorsionado de flúor a -220 ºC, el color se desvanece y permanece como un sólido transparente.
Ahora que las moléculas F2 están tan próximas (pero sin que sus rotaciones moleculares se detengan), pareciera que sus electrones ganan cierta estabilidad y, por tanto, su salto electrónico es demasiado grande para que la luz siquiera interaccione con el cristal.
Fases cristalinas
Este cristal cúbico corresponde a la fase β (no es un alótropo porque sigue siendo el mismo F2). Cuando la temperatura desciende todavía más, hasta los -228 ºC, el flúor sólido sufre una transición de fase; el cristal cúbico se transforma en uno monoclínico, la fase α:
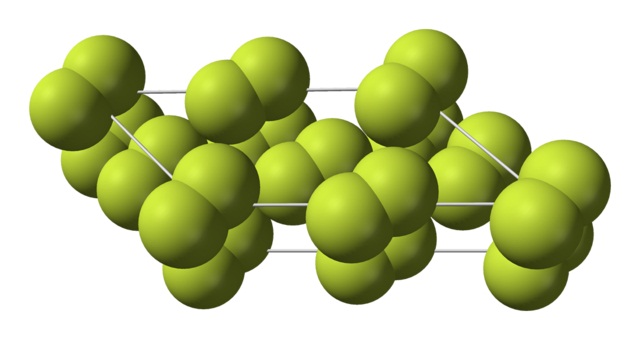
A diferencia del β-F2, el α-F2 es opaco y duro. Quizás se deba a que las moléculas F2 ya no tengan tanta libertad para rotar en sus posiciones fijas en los cristales monoclínicos; donde interaccionan en mayor grado con la luz, pero sin excitar sus electrones (lo cual explicaría superficialmente su opacidad).
La estructura cristalina del α-F2 fue difícil de estudiar mediante métodos convencionales de difracción de rayos X. Esto se debe a que la transición de la fase β a la α es muy exotérmica; por lo que el cristal prácticamente explotaba, al mismo tiempo que interaccionaba poco con las radiaciones.
Pasaron cerca de cincuenta años antes de que científicos alemanes (Florian Kraus y colaboradores), descifraran por completo la estructura del α-F2 con mayor precisión gracias a técnicas de difracción de neutrones.
El flúor ocupa el lugar 24 de los elementos más comunes en el Universo. Sin embargo, en la Tierra es en masa el 13vo elemento, con una concentración de 950 ppm en la corteza terrestre, y una concentración de 1,3 ppm en el agua de mar.
Los suelos tiene una concentración de flúor entre 150 y 400 ppm, y en algunos suelos la concentración puede llegar a 1.000 ppm. En el aire atmosférico está presente en una concentración de 0,6 ppb; pero se ha registrado en algunas ciudades hasta 50 ppb.
El flúor se obtiene principalmente de tres minerales: la fluorita o fluorospar (CaF2), la fluoroapatita [Ca5(PO4)3F] y la criolita (Na3AlF6).
Después de recolectadas las rocas con el mineral fluorita, estas son sometidas a una trituración primaria y secundaria. Con la trituración secundaria de obtienen fragmentos rocosos muy pequeños.
Luego, los fragmentos rocosos se llevan a un molino de bolas para su reducción a polvo. Se agrega agua y reactivos para formar una pasta, la cual se coloca en un tanque de flotación. Se le inyecta aire a presión para formar burbujas, y así la fluorita termina flotando sobre la superficie acuosa.
Los silicatos y los carbonatos se sedimentan mientras la fluorita se recoge y lleva a los hornos de secado.
Una vez obtenida la fluorita se hace reaccionar con ácido sulfúrico para producir el fluoruro de hidrógeno:
CaF2 + H2SO4 => 2 HF + CaSO4
En la producción de flúor se sigue, con algunas modificaciones, el método usado por Moisson en 1886.
Se hace una electrólisis de una mezcla de fluoruro de potasio fundido y ácido fluohídrico, con un radio molar de 1:2,0 a 1:2,2. La temperatura de la sal fundida es de 70 – 130 ºC.
El cátodo consiste de una aleación Monel o acero, y el ánodo es de carbón desgrafitado. El proceso de producción de flúor durante la electrólisis puede esquematizarse en la forma siguiente:
2HF => H2 + F2
Se usa agua para enfriar la cámara de la electrólisis, pero la temperatura debe estar por encima del punto de fusión del electrolito para evitar su solidificación. El hidrógeno producido en la electrólisis se recoge en el cátodo, mientras que el flúor en el ánodo.
El flúor tiene 18 isótopos, siendo el 19F el único isótopo estable con un 100% de abundancia. El 18F tiene una vida media de 109,77 minutos y es el isótopo radiactivo del flúor con la mayor vida media. El 18F se utiliza como fuente de positrones.
No se conoce ninguna actividad metabólica del flúor en los mamíferos o en las plantas superiores. No obstante, algunas plantas y esponjas marinas sintetizan el monofluroacetato, un compuesto venenoso, que utilizan como una protección para evitar su destrucción.
El consumo excesivo de flúor ha sido asociado con fluorosis ósea en adultos y fluorosis dental en niños, así como con alteraciones en el funcionamiento renal. Por esta razón, The United States Public Health Service (PHS) sugirió que la concentración de flúor en el agua potable no debería ser mayor de 0,7 mg/L.
Mientras, la The Us Enviromental Protection Agency (EPA) estableció que la concentración de flúor en el agua potable no debe ser mayor a 4mg/L, con el fin de evitar la fluorosis esquelética, en la cual se acumula flúor en los huesos. Esto puede ocasionar debilitamiento del hueso y fracturas.
El flúor ha sido relacionado con un daño en la glándula paratiroidea, con una disminución del calcio en las estructuras óseas y concentraciones elevadas del calcio en el plasma.
Entre las alteraciones atribuidas al exceso de flúor están las siguientes: fluorosis dental, fluorosis esquelética y daño en la glándula paratiroidea.
La fluorosis dental se presenta con pequeñas rayas o motas en el esmalte del diente. Los niños menores de 6 años no deberían usar enjuagues bucales que contienen flúor.
En la fluorosis esquelética puede diagnosticarse dolor y daño en los huesos, así como en las articulaciones. El hueso puede endurecerse y perder elasticidad, lo que aumenta el riesgo de fracturas.

Empezamos con el apartado de los usos para el flúor con aquel más conocido: el de servir como componente de muchas pastas dentales. Este no es el único uso donde se aprecia el contraste entre su molécula F2, sumamente venenosa y peligrosa, y el anión F–, el cual dependiendo de su entorno puede resultar beneficioso (aunque a veces no).
Cuando ingerimos alimentos, en especial los dulces, las bacterias los degradan aumentando la acidez de nuestra saliva. Entonces, llega un punto en donde el pH es lo suficiente ácido para degrada y desmineralizar el esmalte dental; la hidroxiapatita se viene “abajo”.
Empero, en este proceso los iones F– interaccionan con los Ca2+ para formar una matriz de fluorapatita; más estable y duradera que la hidroxiapatita. O al menos, este es el mecanismo propuesto para explicar la acción del anión fluoruro sobre los dientes. Es probable que sea más compleja y que haya un equilibrio hidroxiapatita-fluorapatita dependiente del pH.
Estos aniones F– vienen disponibles en las pantas dentales en forma de sales; tales como: NaF, SnF2 (el famoso fluoruro estañoso) y NaPOF. Sin embargo, la concentración del F– debe ser baja (menor al 0,2%), ya que de lo contrario causa efectos negativos en el organismo.
Muy parecido a como sucede con las pastas dentales, sales de fluoruro se han añadido a fuentes de agua potable para combatir la aparición de las caries en quienes la beben. La concentración debe ser todavía mucho menor (0,7 ppm). No obstante, esta práctica suele ser objeto de desconfianza y controversias, pues se le ha atribuido posibles efectos cancerígenos.
El gas F2 se comporta como un agente oxidante muy fuerte. Esto hace que muchos compuestos ardan con mayor prontitud que cuando se exponen al oxígeno y a una fuente de calor. Es por eso que se ha utilizado en mezclas combustibles para cohetes, en las cuales pueden reemplazar inclusive al ozono.
En muchos usos las aportaciones del flúor no se deben al F2 o F–, sino directamente a sus átomos electronegativos formando parte de un compuesto orgánico. Se habla pues en esencia de un enlace C-F.
Dependiendo de la estructura, los polímeros o fibras con enlaces C-F suelen ser hidrofóbicas, por lo que no se mojan o resisten el ataque del ácido fluorhídrico; o mejor aún, pueden ser excelentes aislantes eléctricos, y materiales útiles con los que se fabrican objetos como tuberías y juntas. El teflón y nafión son ejemplos de estos polímeros fluorados.
La reactividad del flúor deja entredicho su uso para la síntesis de múltiples compuestos fluorados, orgánicos o inorgánicos. En los orgánicos, específicamente aquellos con efectos farmacológicos, sustituir uno de sus heteroátomos por átomos F incrementa (positiva o negativamente) su acción sobre su objetivo biológico.
Es por eso que en la industria farmacéutica siempre está en la mesa la modificación de algunos fármacos añadiéndoles átomos de flúor.
Muy similar ocurre con los herbicidas y fungicidas. El flúor en ellos puede incrementar su acción y efectividad sobre las plagas de insectos y hongos.
El ácido fluorhídrico, debido a su agresividad con el vidrio y las cerámicas, se ha utilizado para grabar piezas delgadas y delicadas de estos materiales; usualmente destinadas para la fabricación de microcomponentes de las computadoras, o para las bombillas eléctricas.
Uno de los usos más relevantes del flúor elemental es el de ayudar a enriquecer el uranio como 235U. Para ello, los minerales de uranio se disuelven en ácido fluorhídrico, produciéndose UF4. Este fluoruro inorgánico luego reacciona con el F2, para transformarse así en UF6 (235UF6 y 238UF6).
Posteriormente, y mediante una centrifugación gaseosa, el 235UF6 se separa del 238UF6 para luego oxidarse y almacenarse como combustible nuclear.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Krämer Katrina. (2019). Frozen fluorine’s structure revisited after 50 years. The Royal Society of Chemistry. Recuperado de: chemistryworld.com
- Wikipedia. (2019). Fluorine. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Fluorine. PubChem Database. CID=24524. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Dr. Doug Stewart. (2019). Fluorine Element Facts. Chemicool. Recuperado de: chemicool.com
- Batul Nafisa Baxamusa. (21 de febrero de 2018). The Surprisingly Common Uses of the Highly Reactive Fluorine. Recuperado de: sciencestruck.com
- Paola Opazo Sáez. (04 de febrero de 2019). Fluoruro en la pasta de dientes: ¿es bueno o malo para la salud? Recuperado de: nacionfarma.com
- Karl Christe & Stefan Schneider. (08 de mayo de 2019). Fluorine: chemical element. Encyclopædia Britannica. Recuperado de: britannica.com
- Lenntech B.V. (2019). Periodic table: oxygen. Recuperado de: lenntech.com
- Gagnon Steve. (s.f.). The element fluorine. Jefferson Lab. Recuperado de: education.jlab.org
- The American Cancer Society medical and editorial content team. (28 de julio de 2015). Water fluoridation and cancer risk. Recuperado de: cancer.org
