Meniscos (química): qué es y tipos
¿Qué es el menisco (química)?
El menisco es la curvatura de la superficie de un líquido. Asimismo, es la superficie libre de un líquido en la interfaz líquido-aire. Los líquidos se caracterizan por tener un volumen fijo, siendo poco compresibles.
Sin embargo, la forma de los líquidos varía adoptando la forma del recipiente que los contiene. Esta característica se debe al movimiento aleatorio de las moléculas que los forman.
Los líquidos tienen la capacidad de fluir, alta densidad y se difunden con rapidez en otros líquidos con los cuales son miscibles.
Ocupan por gravedad la zona más baja del recipiente, dejando en la parte superior una superficie libre no totalmente plana. En algunas circunstancias pueden adoptar formas especiales como gotas, pompas y burbujas.
Las propiedades de los líquidos como el punto de fusión, la presión de vapor, la viscosidad y el calor de vaporización dependen de la intensidad de las fuerzas intermoleculares que le dan la cohesión a los líquidos.
No obstante, los líquidos también interactúan con el recipiente mediante las fuerzas de adhesión.
El menisco entonces surge de estos fenómenos físicos: la diferencia entre las fuerzas de cohesión entre las partículas del líquido, y las de adhesión, que les permite mojar las paredes.
¿En qué consiste el menisco?
Como acaba de explicarse, el menisco es el resultado de varios fenómenos físicos, entre los cuales también puede mencionarse la tensión superficial del líquido.
Fuerzas de cohesión
Las fuerzas de cohesión es el término físico que explica las interacciones intermoleculares dentro del líquido. En el caso del agua, las fuerzas de cohesión se deben a la interacción dipolo-dipolo y a los puentes de hidrógeno.
La molécula de agua es de naturaleza bipolar. Esto es porque el oxígeno de la molécula es electronegativo por tener mayor avidez por los electrones que los hidrógenos, lo que determina que el oxígeno queda con una carga negativa y los hidrógenos se cargan positivamente.
Hay una atracción electrostática entre la carga negativa de una molécula de agua, localizada en el oxígeno, y la carga positiva de otra molécula de agua, localizada en los hidrógenos.
Esta interacción es lo que conoce como interacción o fuerza dipolo-dipolo, que contribuye a la cohesión del líquido.
Fuerzas de adhesión
Por otro lado, las moléculas de agua pueden interaccionar con las paredes de vidrio, mediante la carga parcial de los átomos de hidrógeno de las moléculas de agua que se unen con fuerza a los átomos de oxígeno de la superficie del vidrio.
Esto constituye la fuerza de adhesión entre el líquido y la pared rígida, lo que coloquialmente significa que el líquido moja la pared.
Cuando se coloca sobre la superficie del vidrio una solución de silicona, el agua no impregna completamente el vidrio, sino que se forman sobre este unas gotitas que se eliminan fácilmente.
Así, se indica que con este tratamiento se disminuye la fuerza de adhesión entre el agua y el vidrio.
Un caso muy similar ocurre cuando las manos están aceitosas, y al lavarlas con agua, se pueden apreciar sobre la piel gotas muy definidas en lugar de la piel humedecida.
Tipos de meniscos
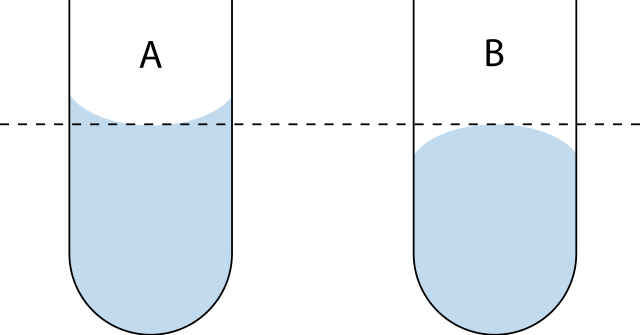
Hay dos tipos de meniscos: el cóncavo y el convexo. En la imagen superior, el cóncavo es el A y el convexo el B. Las líneas punteadas señalan el enrase correcto a la hora de leer una medida de volumen.
Menisco cóncavo
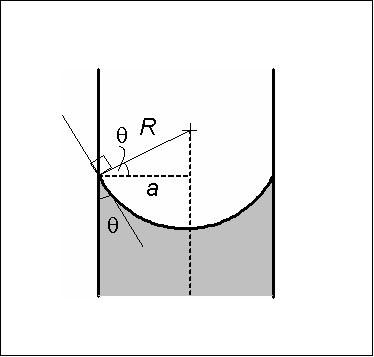
El menisco cóncavo se caracteriza porque el ángulo de contacto θ que forman la pared del vidrio con una línea tangente al menisco, que se introduce en el seno del líquido, tiene un valor menor a 90º.
Si se coloca una cantidad del líquido sobre el vidrio, tiende a extenderse sobre la superficie del vidrio.
La presencia de un menisco cóncavo pone en evidencia que las fuerzas de cohesión en el seno del líquido son menores que la fuerza de adhesión líquido-pared de vidrio.
Por lo tanto, el líquido baña o moja la pared de vidrio, reteniendo una cantidad de líquido y dándole forma cóncava al menisco. El agua es un ejemplo de un líquido que forma meniscos cóncavos.
Menisco convexo
En el caso del menisco convexo, el ángulo de contacto θ tiene un valor mayor a 90º. El mercurio es un ejemplo de un líquido que forma meniscos convexos. Cuando se coloca una gota de mercurio sobre una superficie de vidrio, el ángulo de contacto θ tiene un valor de 140º.
La observación de un menisco convexo indica que las fuerzas de cohesión del líquido son de mayor magnitud que la fuerza de adhesión entre el líquido y la pared de vidrio. Se dice que el líquido no moja el vidrio.
Las fuerzas superficiales de cohesión (líquido-líquido) y adhesión (líquido-sólido) son responsables de muchos fenómenos de interés biológico, como el caso de la tensión superficial y la capilaridad.
Tensión superficial
La tensión superficial es una fuerza neta de atracción ejercida sobre las moléculas del líquido que se encuentran en la superficie y que tiende a introducirlas en el seno del líquido.
Por lo tanto, la tensión superficial tiende a cohesionar al líquido y dar meniscos más cóncavos. Dicho de otra forma, esta fuerza tiende a retirar la superficie del líquido de la pared de vidrio.
La tensión superficial tiende a disminuir a medida que aumenta la temperatura, así por ejemplo: la tensión superficial del agua es igual a 0,076 N/m a 0 °C y 0,059 N/m a 100 °C.
Mientras que la tensión superficial del mercurio a 20 °C es de 0,465 N/m. Esto explicaría por qué el mercurio forma meniscos convexos.
Capilaridad
Si el ángulo de contacto θ es menor de 90º, y el líquido moja la pared de vidrio, el líquido dentro de los capilares de vidrio puede ascender hasta alcanzar una condición de equilibrio.
El peso de la columna de líquido se compensa por el componente vertical de la fuerza de cohesión debida a la tensión superficial. La fuerza de adhesión no interviene por ser perpendicular a la superficie del tubo.
Esta ley no explica cómo el agua puede ascender desde las raíces hasta las hojas a través de los vasos del xilema.
En realidad, hay otros factores que intervienen al respecto, por ejemplo: al evaporarse el agua en las hojas permite que las moléculas de agua en la parte superior de los capilares sean succionadas.
Esto permite que otras moléculas de la parte inferior de los capilares puedan ascender para ocupar el sitio de las moléculas de agua evaporadas.
Referencias
- Whitten, Davis, Peck & Stanley. Química. CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. How to Read a Meniscus in Chemistry. Recuperado de thoughtco.com
