Anhídridos: propiedades, cómo se forman y aplicaciones
Los anhídridos son compuestos químicos que se originan de la unión de dos moléculas mediante la liberación de agua. Así, podría verse como una deshidratación de las sustancias iniciales; aunque no es precisamente cierto.
En química orgánica e inorgánica se hace mención de ellos, y en ambas ramas su comprensión difiere en un grado apreciable. Por ejemplo, en química inorgánica se consideran los óxidos básicos y ácidos como los anhídridos de sus hidróxidos y ácidos respectivamente, ya que los primeros reaccionan con el agua para formar los segundos.
Aquí puede generarse una confusión entre los términos ‘anhidro’ y ‘anhídrido’. Generalmente, anhidro alude a un compuesto al cual se ha deshidratado sin cambios en su naturaleza química (no hay reacción); mientras que con un anhídrido, sí hay un cambio químico, reflejado en la estructura molecular.
Si se comparan los hidróxidos y ácidos con sus óxidos (o anhídridos) correspondientes, se observará que sí hubo una reacción. En cambio, algunos óxidos o sales pueden estar hidratados, perder agua, y continuar siendo los mismos compuestos; pero, sin agua, es decir, anhidros.
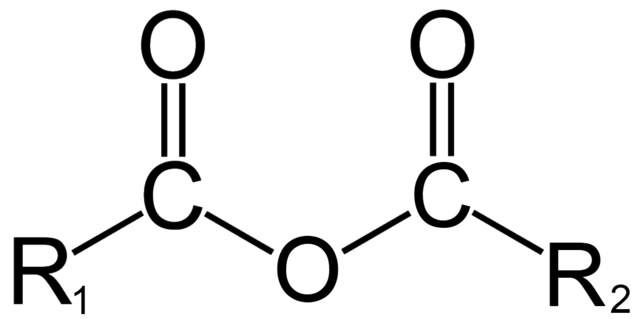
En química orgánica, por otro lado, lo que se entiende por anhídrido es la definición inicial. Por ejemplo, uno de los anhídridos más conocidos son los derivados de los ácidos carboxílicos (imagen superior). Estos consisten en la unión de dos grupos acilo (–RCO) mediante un átomo de oxígeno.
En su estructura general se indica R1 para un grupo acilo, y R2 para el segundo grupo acilo. Debido a que R1 y R2 son diferentes, provienen de ácidos carboxílicos distintos y se trata entonces de un anhídrido ácido asimétrico. Cuando ambos sustituyentes R (sean o no aromáticos) son iguales, se habla en ese caso de un anhídrido ácido simétrico.
Al momento de enlazarse dos ácidos carboxílicos para formar el anhídrido, puede o no formarse agua, así como otros compuestos. Todo dependerá de la estructura de dichos ácidos.
Índice del artículo
- 1 Propiedades de los anhídridos
- 2 ¿Cómo se forman los anhídridos?
- 3 Nomenclatura
- 4 Aplicaciones
- 5 Ejemplos
- 6 Referencias
Las propiedades de los anhídridos dependerán de a cuales se está refiriendo. Casi todos tienen en común que reaccionan con el agua. Sin embargo, para los llamados anhídridos básicos en inorgánica, realmente varios de ellos son incluso insolubles en agua (MgO), por lo que se centrará esta afirmación para los anhídridos de los ácidos carboxílicos.
Los puntos de fusión y ebullición recaen en la estructura molecular y en las interacciones intermoleculares para el (RCO)2O, siendo esta la fórmula química general de estos compuestos orgánicos.
Si la masa molecular de (RCO)2O es baja, probablemente sea un líquido incoloro a temperatura y presión ambiente. Por ejemplo, el anhídrido acético (o anhídrido etanoico), (CH3CO)2O, es un líquido y el de mayor importancia industrial, siendo muy vasta su producción.
La reacción entre el anhídrido acético y el agua viene representada por la siguiente ecuación química:
(CH3CO)2O + H2O => 2CH3COOH
Notese que al adicionarse la molécula de agua, se liberan dos moléculas de ácido acético. La reacción inversa, sin embargo, no puede darse para el ácido acético:
2CH3COOH => (CH3CO)2O + H2O (No ocurre)
Es necesario recurrir a otra ruta sintética. Los ácidos dicarboxílicos, por otro lado, sí pueden hacerlo mediante calentamiento; pero se explicará en el próximo apartado.
Hidrólisis
Una de las reacciones más simples de los anhídridos es su hidrólisis, la cual se acaba de mostrar para el anhídrido acético. Además de este ejemplo, se tiene el del anhídrido ácido sulfúrico:
H2S2O7 + H2O => 2H2SO4
Aquí se tiene un anhídrido ácido inorgánico. Nótese que para el H2S2O7 (llamado también ácido disulfúrico), la reacción sí es reversible, por lo que calentando H2SO4 concentrado da lugar a la formación de su anhídrido. Si, por otro lado, se trata de una disolución diluida de H2SO4, se libera SO3, anhídrido sulfúrico.
Esterificación
Los anhídridos ácidos reaccionan con los alcoholes, con piridina en el medio, para dar lugar a un éster y un ácido carboxílico. Por ejemplo, se considera la reacción entre el anhídrido acético y el etanol:
(CH3CO)2O + CH3CH2OH => CH3CO2CH2CH3 + CH3COOH
Formándose así el éster etanoato de etilo, CH3CO2CH2CH3, y el ácido etanoico (ácido acético).
Prácticamente, lo que ocurre es la sustitución del hidrógeno del grupo hidroxilo, por un grupo acilo:
R1-OH => R1-OCOR2
En el caso del (CH3CO)2O, su grupo acilo es el –COCH3. Por lo tanto, se dice que el grupo OH está sufriendo acilación. Sin embargo, la acilación y esterificación no son conceptos intercambiables; la acilación puede ocurrir directamente en un anillo aromático, conocida con el nombre de acilación de Friedel-Crafts.
Así, los alcoholes en presencia de los anhídridos ácidos se esterifican mediante una acilación.
Por otro lado, solo uno de los dos grupos acilo reacciona con el alcohol, el otro se queda con el hidrógeno formando un ácido carboxílico; que para el caso del (CH3CO)2O, es el ácido etanoico.
Amidación
Los anhídridos ácidos reaccionan con el amoníaco o con las aminas (primarias y secundarias), para dar lugar a amidas. La reacción es muy similar a la esterificación recién descrita, pero se sustituye el ROH por una amina; por ejemplo, una amina secundaria, R2NH.
Nuevamente, se considera la reacción entre (CH3CO)2O y la dietilamina, Et2NH:
(CH3CO)2O + 2Et2NH => CH3CONEt2 + CH3COO–+NH2Et2
Y se forman dietilacetamida, CH3CONEt2, y una sal de carboxilado de amonio, CH3COO–+NH2Et2.
Aunque la ecuación pueda parecer un poco difícil de comprender, basta con observar cómo el grupo –COCH3 sustituye el H de un Et2NH para formar la amida:
Et2NH => Et2NCOCH3
Más que una amidación, la reacción sigue tratándose de una acilación. Todo se resume en esa palabra; esta vez, la amina sufre la acilación y no el alcohol.
Los anhídridos inorgánicos se forman reaccionando el elemento con el oxígeno. Así, si el elemento es metálico, se forma un óxido metálico o anhídrido básico; y si es no metálico, se forma un óxido no metálico o anhídrido ácido.
Para los anhídridos orgánicos, la reacción es otra. Dos ácidos carboxílicos no pueden unirse directamente para liberar agua y formar el anhídrido ácido; es necesaria la participación de un compuesto del que no se ha hecho mención todavía: el cloruro de acilo, RCOCl.
El ácido carboxílico reacciona con el cloruro de acilo, produciendo el respectivo anhídrido y cloruro de hidrógeno:
R1COCl + R2COOH => (R1CO)O(COR2) + HCl
CH3COCl + CH3COOH => (CH3CO)2O + HCl
Un CH3 proviene del grupo acetilo, CH3CO–, y el otro ya está presente en el ácido acético. La elección de un cloruro de acilo específico, así como del ácido carboxílico, puede dar origen a la síntesis de un anhídrido ácido simétrico o asimétrico.
A diferencia de los otros ácidos carboxílicos que requieren de un cloruro de acilo, los ácidos dicarboxílicos pueden condensarse en su anhídrido correspondiente. Para ello, es necesario calentarlos para promover la liberación del H2O. Por ejemplo, se muestra la formación del anhídrido ftálico a partir del ácido ftálico.
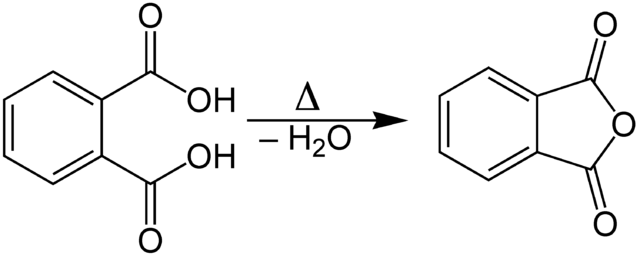
Nótese cómo se completa el anillo pentagonal, y el oxígeno que une ambos grupos C=O forma parte del mismo; este es un anhídrido cíclico. Asimismo, puede apreciarse que el anhídrido ftálico es un anhídrido simétrico, ya que tanto R1 como R2 son idénticos: un anillo aromático.
No todos los ácidos dicarboxílicos son capaces de formar su anhídrido, ya que cuando sus grupos COOH están muy separados, se ven obligados a completar anillos cada vez más grandes. El anillo más grande que puede formarse es uno hexagonal, más grandes que ese la reacción no toma lugar.
¿Cómo se nombran los anhídridos? Dejando a un lado los inorgánicos, pertinentes a temas de óxidos, los nombres de los anhídridos orgánicos hasta ahora explicados dependen de la identidad de R1 y R2; es decir, de sus grupos acilo.
Si los dos R son iguales, basta con sustituir la palabra ‘ácido’ por ‘anhídrido’ en el nombre respectivo del ácido carboxílico. Y si, por el contrario, los dos R son diferentes, se nombran en orden alfabético. Por lo tanto, para saber cómo llamarlo hay que ver primeramente si se trata de un anhídrido ácido simétrico o asimétrico.
El (CH3CO)2O es simétrico, ya que R1= R2 = CH3. Deriva del ácido acético o etanoico, por lo que su nombre es, siguiendo la explicación anterior: anhídrido acético o etanoico. Lo mismo sucede con el anhídrido ftálico recién mencionado.
Supóngase que se tiene el siguiente anhídrido:
CH3CO(O)COCH2CH2CH2CH2CH2CH3
El grupo acetilo de la izquierda proviene del ácido acético, y el de la derecha, del ácido heptanoico. Para nombrar a este anhídrido debe nombrar sus grupos R en orden alfabético. Entonces, su nombre es: anhídrido acético heptanoico.
Los anhídridos inorgánicos tienen un sinfín de aplicaciones, desde la síntesis y formulación de materiales, cerámicas, catalizadores, cementos, electrodos, fertilizantes, etc., hasta como recubrimiento de la corteza terrestre con sus miles de minerales de hierro y aluminio, y el dióxido de carbono exhalado por los organismos vivos.
Representan la fuente de partida, el punto donde derivan muchos compuestos utilizados en síntesis inorgánicas. Uno de los anhídridos más importante es el del carbónico, CO2. Es, junto con el agua, imprescindible para la fotosíntesis. Y a nivel industrial, el SO3 es primordial dado que a partir de él se obtiene el demandado ácido sulfúrico.
Quizás, el anhídrido con más aplicaciones habidas y por haber (mientras haya vida) es uno proveniente del ácido fosfórico: adenosina trifosfato, mejor conocido como ATP, presente en el ADN y “moneda energética” del metabolismo.
Los anhídridos ácidos reaccionan mediante una acilación, ya sea a un alcohol, formando un éster, a una amina, dando lugar a una amida, o a un anillo aromático.
Hay millones de cada uno de estos compuestos, y cientos de miles de opciones de ácidos carboxílicos para preparar un anhídrido; por lo tanto, las posibilidades sintéticas crecen drásticamente.
Siendo así, uno de las principales aplicaciones es el de incorporar un grupo acilo a un compuesto, sustituyendo uno de los átomos o grupos de su estructura.
Cada anhídrido por separado tiene sus propias aplicaciones, pero en términos generales todos reaccionan de un modo parecido. Por esa razón este tipo de compuestos se utilizan para modificar las estructuras poliméricas, creando polímeros nuevos; es decir, copolímeros, resinas, recubrimientos, etc.
Por ejemplo, el anhídrido acético se utiliza para acetilar todos los grupos OH de la celulosa (imagen inferior). Con ello, cada H de los OH se sustituye por un grupo acetilo, COCH3.
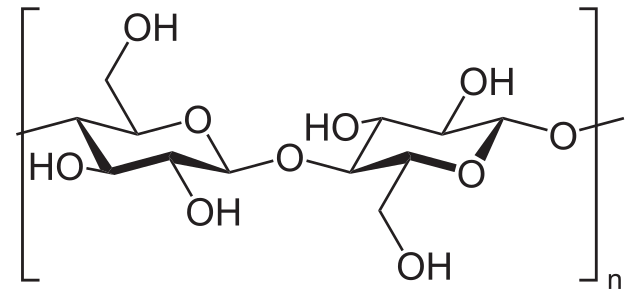
De esta manera se obtiene el polímero acetato de celulosa. La misma reacción puede bosquejarse con otras estructuras poliméricas con grupos NH2, también susceptibles frente a la acilación.
Estas reacciones de acilación son útiles también para la síntesis de fármacos, como la aspirina (ácido acetilsalicílico).
Se muestran para finalizar algunos otros ejemplos de anhídridos orgánicos. Aunque no se hará mención de ellos, los átomos de oxígeno pueden sustituirse por azufre, dando anhídridos sulfurados, o inclusive fosforados.
-C6H5CO(O)COC6H5: anhídrido benzoico. El grupo C6H5 representa un anillo bencénico. Su hidrólisis produce dos ácidos benzoico.
-HCO(O)COH: anhídrido fórmico. Su hidrólisis produce dos ácidos fórmicos.
– C6H5CO(O)COCH2CH3: anhídrido benzoico propanoico. Su hidrólisis produce los ácidos benzoico y propanoico.
-C6H11CO(O)COC6H11: anhídrido ciclohexanocarboxílico. A diferencia de los anillos aromáticos, estos están saturados, sin dobles enlaces.
-CH3CH2CH2CO(O)COCH2CH3: anhídrido butanoico propanoico.
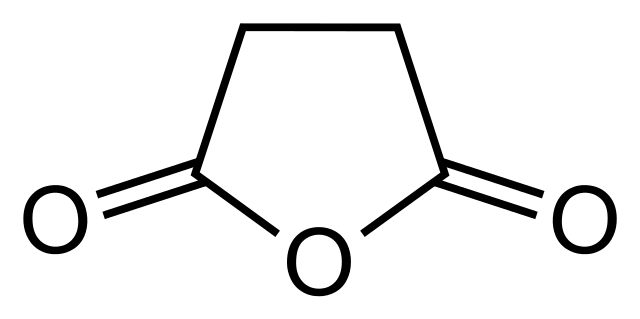
Aquí se tiene otro cíclico, derivado del ácido succínico, un ácido dicarboxílico. Nótese como los tres átomos de oxígeno delatan la naturaleza química de este tipo de compuesto.
El anhídrido maleico es muy parecido al del succínico, con la diferencia de que hay un doble enlace entre los carbonos que forman la base del pentágono.
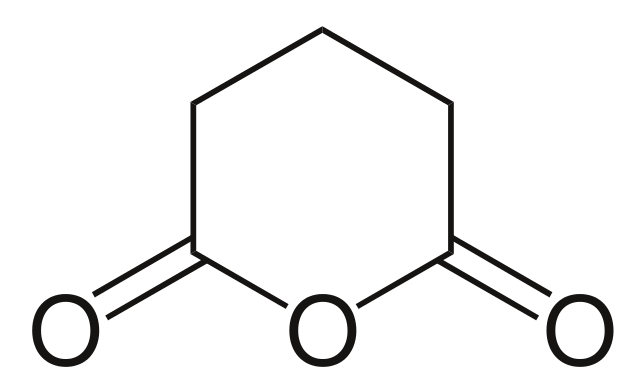
Y para finalizar se muestra el anhídrido del ácido glutárico. Este estructuralmente se distingue de todos los demás por consistir de un anillo hexagonal. Nuevamente, los tres átomos de oxígeno resaltan en la estructura.
Otros anhídridos, más complejos, pueden siempre evidenciarse por los tres átomos de oxígeno muy cercanos entre sí.
- The Editors of Encyclopaedia Britannica. (2019). Anhydride. Enclyclopaedia Britannica. Recuperado de: britannica.com
- Helmenstine, Anne Marie, Ph.D. (08 de enero de 2019). Acid Anhydride Definition in Chemistry. Recuperado de: thoughtco.com
- Chemistry LibreTexts. (s.f.). Anhydrides. Recuperado de: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Organic acid anhydride. Recuperado de: en.wikipedia.org
