Hidróxidos: qué son, propiedades, nomenclatura y ejemplos
¿Qué son los hidróxidos?
Los hidróxidos son compuestos inorgánicos y ternarios que consisten en la interacción entre un catión metálico y el grupo funcional OH (anión hidróxido, OH–). La mayoría de ellos son de naturaleza iónica, aunque también pueden tener enlaces covalentes.
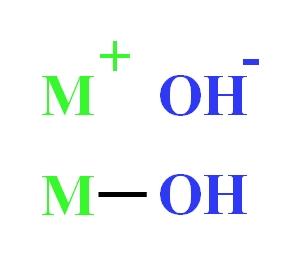
Por ejemplo, un hidróxido puede representarse como la interacción electrostática entre el catión M+ y el anión OH–, o como la unión covalente mediante el enlace M-OH (imagen inferior). En la primera se da el enlace iónico, mientras que en la segunda el covalente. Este hecho depende esencialmente del metal o catión M+, así como de su carga y radio iónico.
Debido a que gran parte de ellos provienen de los metales, resulta equivalente mencionarlos como hidróxidos metálicos.
¿Cómo se forman los hidróxidos?
Existen dos rutas sintéticas principales: mediante la reacción del óxido correspondiente con el agua, o con una base fuerte en un medio ácido:
MO + H2O => M(OH)2
MO + H+ + OH– => M(OH)2
Únicamente aquellos óxidos metálicos solubles en agua reaccionan directamente para formar el hidróxido (primera ecuación química). Otros son insolubles y requieren de especies ácidas que liberen M+, el cual interacciona seguidamente con los OH– provenientes de las bases fuertes (segunda ecuación química).
Sin embargo, dichas bases fuertes son hidróxidos metálicos NaOH, KOH y otros del grupo de los metales alcalinos (LiOH, RbOH, CsOH). Estos son compuestos iónicos altamente solubles en agua, por lo tanto, sus OH– están libres para participar en reacciones químicas.
Por otro lado, existen hidróxidos metálicos insolubles y en consecuencia son bases muy débiles. Incluso algunos de ellos son ácidos, como ocurre con el ácido telúrico, Te(OH)6.
El hidróxido establece un equilibrio de solubilidad con el solvente a su alrededor. Si es el agua, por ejemplo, se expresa entonces el equilibrio como sigue a continuación:
M(OH)2 => M2+(ac) + OH–(ac)
Donde (ac) denota que el medio es acuoso. Cuando el sólido es insoluble, la concentración de OH disuelta es pequeña o despreciable. Por esta razón, los hidróxidos metálicos insolubles no pueden generar soluciones tan básicas como las de NaOH.
A partir de lo anterior puede deducirse que los hidróxidos exhiben propiedades muy diferentes, vinculadas con la estructura química y las interacciones entre el metal y el OH. Así, aunque muchos sean iónicos, con estructuras cristalinas variadas, otros en cambio presentan estructuras poliméricas complejas y desordenadas.
Propiedades de los hidróxidos
Anión OH–
El ion hidroxilo es un átomo de oxígeno enlazado covalentemente a un hidrógeno. Así, este puede representarse fácilmente como OH–. La carga negativa se ubica sobre el oxígeno, haciendo de este anión una especie donadora de electrones: una base.
Si el OH– dona sus electrones a un hidrógeno, se forma una molécula de H2O. También puede donar sus electrones a especies de carga positiva: como los centros metálicos M+. Así, se forma un complejo de coordinación a través del enlace dativo M–OH (el oxígeno aporta el par de electrones).
Sin embargo, para que suceda esto, el oxígeno debe ser capaz de coordinarse eficientemente con el metal, de lo contrario, las interacciones entre M y OH tendrán un marcado carácter iónico (M+ OH–).
Como el ion hidroxilo es el mismo en todos los hidróxidos, la diferencia entre todos ellos radica entonces en el catión que lo acompaña.
Asimismo, debido a que este catión puede proceder de cualquier metal de la tabla periódica (grupos 1, 2, 13, 14, 15, 16, o de los metales de transición), las propiedades de tales hidróxidos varían enormemente, aunque todos contemplan en común algunos aspectos.
Carácter iónico y básico
Los hidróxidos, aunque posean enlaces de coordinación, poseen un latente carácter iónico. En algunos, como el NaOH, sus iones forman parte de una red cristalina constituida por cationes Na+ y aniones OH– en proporciones 1:1; es decir, por cada ion Na+ hay un ion OH– de contraparte.
Dependiendo de la carga del metal, habrá más o menos aniones OH– a su alrededor. Por ejemplo, para un catión metálico M2+ habrá dos iones OH– interaccionando con él: M(OH)2, lo que se bosqueja como HO– M2+ OH–.
Del mismo modo ocurre con los metales M3+ y con otros de cargas más positivas (aunque raras veces superan a 3+).
Este carácter iónico es responsable de muchas de las propiedades físicas, como los puntos de fusión y ebullición. Estos son altos, lo cual refleja las fuerzas electrostáticas que obran dentro de la red cristalina. Asimismo, cuando los hidróxidos se disuelven o se funden pueden conducir la corriente eléctrica debido a la movilidad de sus iones.
Sin embargo, no todos los hidróxidos presentan iguales redes cristalinas. Aquellos con las más estables, serán menos propensos a disolverse en solventes polares como el agua. Como regla general, mientras más dispares sean los radios iónicos de M+ y OH–, más solubles serán los mismos.
Tendencia periódica
Lo anterior explica por qué la solubilidad de los hidróxidos de los metales alcalinos aumenta conforme se desciende por el grupo. Así, el orden creciente de solubilidades en agua para estos es el siguiente: LiOH El OH– es un anión pequeño, y a medida que el catión se vuelve más voluminoso, la red cristalina se debilita energéticamente. Por otro lado, los metales alcalinotérreos forman hidróxidos menos solubles debido a sus mayores cargas positivas. Esto se debe a que el M2+ atrae con mayor fuerza a los OH– en comparación con M+. Igualmente, sus cationes son más pequeños, y por tanto menos desiguales en tamaño respecto al OH–. El resultado de esto es la evidencia experimental de que el NaOH es mucho más básico que el Ca(OH)2. El mismo razonamiento puede aplicarse para otros hidróxidos, ya sea para los de los metales de transición, o para los de los metales del bloque p (Al, Pb, Te, etc.). Asimismo, mientras más pequeño y grande sean el radio iónico y la carga positiva de M+, menor será el carácter iónico del hidróxido, en otras palabras, aquellos con densidades de cargas muy altas. Un ejemplo de esto ocurre con el hidróxido de berilio, Be(OH)2. El Be2+ es un catión muy pequeño y su carga divalente lo hace eléctricamente muy denso. Los hidróxidos M(OH)2 reaccionan con los ácidos para formar un acuocomplejo, es decir, M+ termina rodeado de moléculas de agua. Sin embargo, existe un número limitado de hidróxidos que también pueden reaccionar con las bases. Estos son los que se conocen como hidróxidos anfóteros. Los hidróxidos anfóteros reaccionan tanto con ácidos como con bases. La segunda situación puede representarse con la siguiente ecuación química: M(OH)2 + OH– => M(OH)3– Pero, ¿cómo determinar si un hidróxido es anfótero? Mediante un simple experimento de laboratorio. Debido a que muchos hidróxidos metálicos son insolubles en agua, al agregar una base fuerte a una solución con los iones M+ disueltos, por ejemplo, Al3+, precipitará el hidróxido correspondiente: Al3+(ac) + 3OH–(ac) => Al(OH)3(s) Pero al haber un exceso de OH– el hidróxido continúa reaccionando: Al(OH)3(s) + OH– => Al(OH)4–(ac) Como resultado, el nuevo complejo con carga negativa es solvatado por las moléculas de agua circundantes, disolviéndose el sólido blanco de hidróxido de aluminio. Aquellos hidróxidos que permanezcan inalterados con la adición extra de base no se comportan como ácidos y, por tanto, no son anfóteros. Los hidróxidos pueden tener estructuras cristalinas semejantes a las de muchas sales u óxidos; algunas simples, y otras muy complejas. Además, aquellas donde haya una disminución del carácter iónico pueden presentar centros metálicos unidos por puentes de oxígeno (HOM–O–MOH). En solución las estructuras son diferentes. Si bien para los hidróxidos muy solubles basta considerarlos como iones disueltos en agua, para otros es necesario tomar en cuenta la química de coordinación. Así, cada catión M+ puede coordinarse a un número limitado de especies. Mientras más voluminoso sea, mayor será el número de moléculas de agua o de OH– enlazados a él. De aquí surge el famoso octaedro de coordinación de muchos metales disueltos en agua (o en cualquier otro solvente): M(OH2)6+n, siendo n igual a la carga positiva del metal. El Cr(OH)3, por ejemplo, forma realmente un octaedro. ¿Cómo? Considerando al compuesto como [Cr(OH2)3(OH)3], del cual tres de las moléculas de agua se sustituyen por aniones OH–. Si todas las moléculas se sustituyeran por OH–, entonces se obtendría el complejo de carga negativa y de estructura octaédrica [Cr(OH)6]3–. La carga -3 es resultado de las seis cargas negativas de los OH–. Los hidróxidos pueden considerarse como “óxidos hidratados”. Sin embargo, en ellos “el agua” se encuentra en contacto directo con M+; mientras que en los óxidos hidratados MO·nH2O, las moléculas de agua forman parte de una esfera externa de coordinación (no están cerca del metal). Dichas moléculas de agua pueden extraerse a través del calentamiento de una muestra de hidróxido: M(OH)2 + Q(calor) => MO + H2O MO es el óxido metálico formado como resultado de la deshidratación del hidróxido. Un ejemplo de esta reacción es el que se observa cuando se deshidrata el hidróxido cúprico, Cu(OH)2: Cu(OH)2 (azul) + Q => CuO (negro) + H2O ¿Cuál es la forma adecuada de mencionar los hidróxidos? La IUPAC planteó tres nomenclaturas para tal propósito: la tradicional, la stock y la sistemática. Es correcto utilizar cualquiera de las tres, sin embargo, para algunos hidróxidos puede que resulte más cómodo o práctico mencionarlo de un modo u otro. La nomenclatura tradicional consiste sencillamente en añadir el sufijo –ico a la valencia más alta que presenta el metal; y el sufijo –oso a la más baja. Así, por ejemplo, si el metal M tiene valencias +3 y +1, el hidróxido M(OH)3 se llamará hidróxido (nombre del metal)ico, mientras que MOH hidróxido (nombre del metal)oso. Para determinar cuál es la valencia del metal en el hidróxido basta con observar el número después del OH encerrado entre paréntesis. Así, M(OH)5 significa que el metal tiene una carga o valencia de +5. El principal inconveniente de esta nomenclatura, no obstante, es que puede resultar complicada para metales con más de dos estados de oxidación (como ocurre con el cromo y el manganeso). Para tales casos se recurre a los prefijos hiper- e hipo- para denotar las valencias más altas y bajas. Así, si M en lugar de tener únicamente valencias +3 y +1, tiene además +4 y +2, entonces los nombres de sus hidróxidos de mayor y menor valencias son: hidróxido hiper(nombre del metal)ico, e hidróxido hipo(nombre del metal)oso. De todas las nomenclaturas, esta es la más simple. Aquí el nombre del hidróxido va seguido sencillamente de la valencia del metal encerrada entre paréntesis y escrita en números romanos. Nuevamente para el M(OH)5, por ejemplo, su nomenclatura stock sería: hidróxido de (nombre del metal)(V). (V) denota entonces (+5). Finalmente, la nomenclatura sistemática se caracteriza por recurrir a los prefijos multiplicadores (di-, tri-, tetra-, penta-, hexa-, etc.). Estos prefijos se utilizan para especificar tanto el número de átomos metálicos como de iones OH–. De esta manera, el M(OH)5 se nombra como: pentahidróxido de (nombre del metal). Para el caso del Hg2(OH)2, por ejemplo, sería dihidróxido de dimercurio; uno de los hidróxidos cuya estructura química resulta compleja a primera vista. Algunos ejemplos de hidróxidos y sus correspondientes nomenclaturas son los que siguen a continuación: -NaOH (Hidróxido de sodio) -Ca(OH)2 (Hidróxido de calcio) -Fe(OH)3 (Hidróxido férrico; hidróxido de hierro (III); o trihidróxido de hierro). -V(OH)5 (Hidróxido pervanádico; hidróxido de vanadio (V); o pentahidróxido de vanadio). -Sn(OH)4 (Hidróxido estáñico; hidróxido de estaño (IV); o tetrahidróxido de estaño). -Ba(OH)2 (Hidróxido de bario o dihidróxido de bario). -Mn(OH)6 (Hidróxido mangánico, hidróxido de manganeso (VI) o hexahidróxido de manganeso). -AgOH (Hidróxido argéntico, hidróxido de plata o hidróxido de plata). Nótese que para este compuesto no existe distinción entre las nomenclaturas stock y sistemática. -Pb(OH)4 (Hidróxido plúmbico, hidróxido de plomo (IV) o tetrahidróxido de plomo). -LiOP (Hidróxido de litio). -Cd(OH)2 (Hidróxido de cadmio). -Ba(OH)2 (Hidróxido de bario). -Hidróxido de cromo.Anfoterismo
Estructuras
Reacción de deshidratación
Nomenclatura de los hidróxidos
Tradicional
Stock
Sistemática
Ejemplos de hidróxidos
Referencias
