Moléculas apolares: características, identificación y ejemplos
Las moléculas apolares son aquellas que presentan en su estructura una distribución simétrica de sus electrones. Esto es posible si la diferencia de electronegatividad de sus átomos es pequeña, o si los átomos o grupos electronegativos cancelan vectorialmente sus efectos en la molécula.
No siempre la “apolaridad” es absoluta. Por esa razón en ocasiones se consideran a las moléculas de escasa polaridad como apolares; esto es, tiene un momento dipolar µ cercano a 0. Aquí se entra en terreno de lo relativo: ¿qué tan bajo debe ser µ para que una molécula o compuesto se considere apolar?
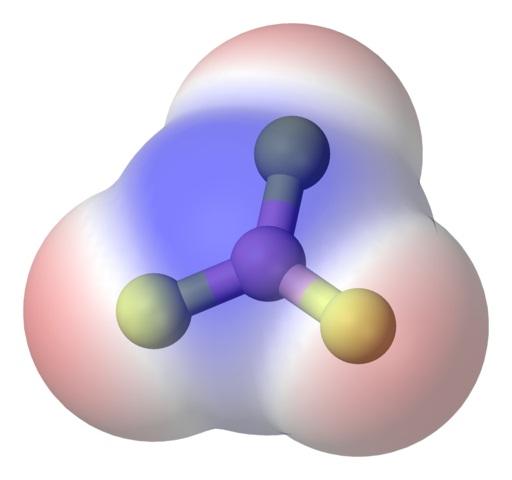
Para abordar mejor el tema se tiene a la molécula de trifluoruro de boro, BF3 (imagen superior).
El átomo de flúor es mucho más electronegativo que el de boro, y por lo tanto los enlaces B-F son polares. Sin embargo, la molécula de BF3 es simétrica (plano trigonal) y conlleva la cancelación vectorial de los tres momentos B-F.
Así, también se generan moléculas apolares, aún con la existencia de enlaces polares. La polaridad generada puede ser balanceada por la existencia de otro enlace polar, de la misma magnitud que el anterior, pero orientado en sentido contrario; tal como se sucede en el BF3.
Índice del artículo
Para que los efectos de los enlaces polares se anulen mutuamente, la molécula debe tener una estructura geométrica determinada; por ejemplo, lineal, la más fácil de entender a primera vista.
Este es el caso del dióxido de carbono (CO2), que posee dos enlaces polares (O=C=O). Esto se debe a que los dos momentos dipolares de los enlaces C=O se cancelan al estar orientados uno hacia un lado, y el segundo hacia el otro, en un ángulo de 180°.
Por lo tanto, una de las primeras características a tener en cuenta cuando se evalúe a vuelo de pájaro la “apolaridad” de una molécula, es observar qué tan simétrica es.
Supóngase que en lugar del CO2 se tiene la molécula COS (O=C=S), llamada sulfuro de carbonilo.
Ahora ya no se trata de una molécula apolar, ya que la electronegatividad del azufre es menor que la del oxígeno; y por lo tanto, el momento dipolar C=S es diferente al del C=O. Como resultado, el COS es una molécula polar (el qué tan polar es harina de otro costal).
La imagen inferior resume de manera gráfica todo lo recién descrito:
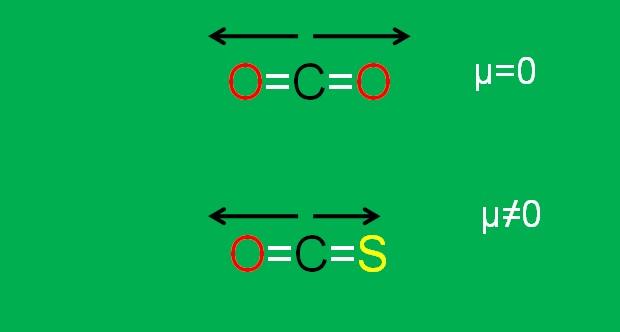
Nótese que el momento dipolar del enlace C=S es menor que el del enlace C=O en la molécula de COS.
La electronegatividad en la escala de Pauling tiene valores comprendidos entre 0,65 (para el francio), y 4,0 (para el flúor). En general, los halógenos presentan una alta electronegatividad.
Cuando la diferencia de la electronegatividad de los elementos que forman un enlace covalente es menor o igual a 0,4, se dice que es apolar o no polar. Sin embargo, las únicas moléculas que son verdaderamente apolares son aquellas formadas por enlaces entre átomos idénticos (como el hidrógeno, H-H).
Para que una sustancia se disuelva en el agua debe interaccionar electrostáticamente con las moléculas; interacciones que no pueden realizar las moléculas apolares.
En las moléculas apolares, sus cargas eléctricas no están confinadas en un extremo de la molécula, sino distribuidas simétricamente (u homogéneamente). Por lo tanto, es incapaz de interactuar mediante fuerzas dipolo-dipolo.
En cambio, las moléculas apolares interactúan entre sí mediante las fuerzas de dispersión de London; estas son, dipolos instantáneos que polarizan la nube electrónica de los átomos de moléculas vecinas. Aquí la masa molecular es un factor predominante en las propiedades físicas de estas moléculas.
-Quizás uno los mejores métodos para identificar una molécula apolar es su solubilidad en distintos solventes polares, siendo generalmente poco solubles en ellos.
-En general, las moléculas apolares son de naturaleza gaseosa. Pueden también ser formar líquidos inmiscibles con el agua.
-Los sólidos apolares se caracterizan por ser blandos.
-Las fuerzas de dispersión que las mantiene unidas son por lo general débiles. Debido a esto, sus puntos de fusión o ebullición tienden a ser inferiores a los de los compuestos de naturaleza polar.
-Las moléculas apolares, especialmente bajo la forma líquida, son malos conductores de la electricidad, ya que carecen de carga eléctrica neta.
Aunque no son moléculas, los gases nobles se consideran apolares. Si se asume que por breves periodos de tiempo interaccionan dos de sus átomos, He—He, dicha interacción podría considerarse (a medias) como una molécula; molécula que sería de naturaleza apolar.
Las moléculas diatómicas, como el H2, el Br2, el I2, el Cl2, el O2, y el F2, son apolares. Estas tienen por fórmula general A2, A-A.
¿Y si A fuera un grupo de átomos? Se estaría ante otros compuestos apolares; por ejemplo, el etano, CH3-CH3, cuyo esqueleto carbonado es lineal, C-C.
El metano, CH4, y el etano, C2H6, son moléculas apolares. El carbono tiene una electronegatividad de 2,55; mientras que la electronegatividad del hidrógeno es 2,2. Por lo tanto, hay un vector dipolo de baja intensidad, orientado desde el hidrógeno hacia el carbono.
Pero, debido a la simetría geométrica de las moléculas de metano y etano, la suma de los vectores dipolo o momentos dipolares en sus moléculas es nula, por lo que no existe una carga neta en las moléculas.
En general sucede lo mismo con todos los hidrocarburos, y aun cuando existan insaturaciones en ellos (dobles y triples enlaces), se consideran apolares o compuestos de baja polaridad. Asimismo, los hidrocarburos cíclicos son moléculas apolares, como el ciclohexano o ciclobutano.
Las moléculas de dióxido de carbono (CO2) y disulfuro de carbono (CS2) son moléculas apolares, ambas con una geometría lineal.
En el disulfuro de carbono, la electronegatividad del carbono es de 2,55, mientras que la electronegatividad del azufre es de 2,58; por lo que ambos elementos tienen, prácticamente, la misma electronegatividad. No hay generación de un vector dipolo y por ende, la carga neta es cero.
Asimismo, se tienen las siguientes moléculas CCl4 y AlBr3, ambas apolares:
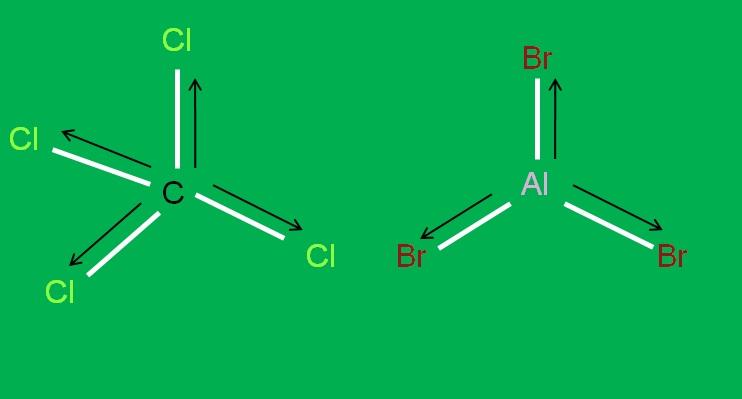
En el tribromuro de aluminio, AlBr3 ocurre lo mismo que con el BF3, al comienzo del artículo. Mientras, para el tetracloruro de carbono, CCl4, la geometría es tetraédrica y simétrica, ya que todos los enlaces C-Cl son iguales.
Del mismo modo, las moléculas con la fórmula general CX4 (CF4, CI4 y CBr4), también son apolares.
Y para finalizar, una molécula apolar puede incluso tener geometría octaédrica, como es el caso del hexafluoruro de azufre, SF6. De hecho, puede tener cualquier geometría o estructura, con tal de que sea simétrica y su distribución electrónica sea homogénea.
- Carey F. A. (2008). Química Orgánica. Ácidos carboxílicos. (Sexta edición). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Polaridad de moléculas. Recuperado de: corinto.pucp.edu.pe
- Tutor Vista. (2018). Nonpolar molecule. Recuperado de: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28 de enero de 2019). Examples of Polar and Nonpolar Molecules. Recuperado de: thoughtco.com
- Kurtus R. (19 de septiembre de 2016). Polar and non-polar molecules. School for Champions. Recuperado de: school-for-champions.com
- Ganong W. (2004). Fisiología Médica. Edición 19ª. Editorial el Manual Moderno.
