Fuerzas de London: qué son, características y ejemplos
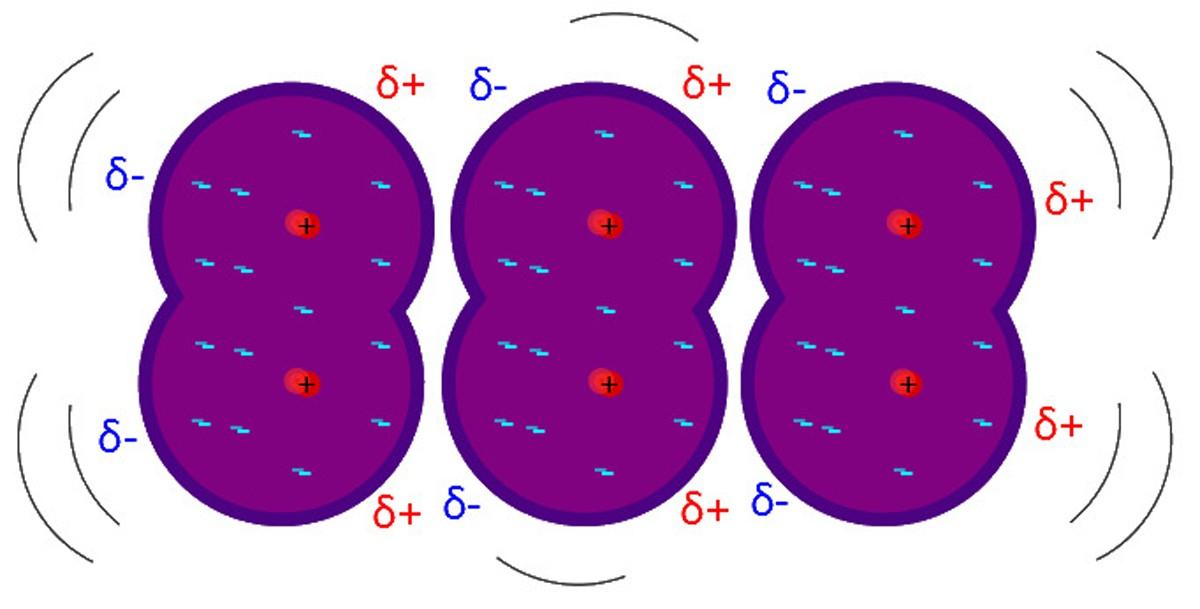
¿Qué son las fuerzas de London?
Las fuerzas de London, fuerzas de dispersión de London o interacciones dipolo inducido-dipolo, son el tipo más débil de interacciones intermoleculares. Su nombre se debe a las contribuciones del físico teórico Fritz London (1900-1954) y a sus estudios dentro del campo de la física cuántica.
Las fuerzas de London explican cómo interactúan moléculas cuyas estructuras y átomos le imposibilitan la formación de un dipolo permanente; es decir, fundamentalmente aplica a las moléculas apolares o a los átomos aislados de los gases nobles.
A diferencia de las demás fuerzas de Van der Waals, esta requiere de distancias extremadamente cortas.
Características de las fuerzas de London
¿Qué características debe poseer una molécula para que pueda interactuar mediante fuerzas de London? La respuesta es que cualquiera podría hacerlo, pero cuando existe un momento dipolar permanente, predominan las interacciones de tipo dipolo-dipolo más que las de dispersión, contribuyendo muy poco a la naturaleza física de las sustancias.
En estructuras donde no haya átomos muy electronegativos o cuya distribución de carga electrostática sea homogénea, no existe un extremo o región que pueda considerarse rica (δ-) o pobre (δ+) en electrones.
En estos casos, otro tipo de fuerzas debe intervenir, o de lo contrario dichos compuestos solo podrían existir en fase gaseosa, sin importar incluso cuáles sean las condiciones de presión o temperatura operando sobre ellos.
Distribución de carga homogénea
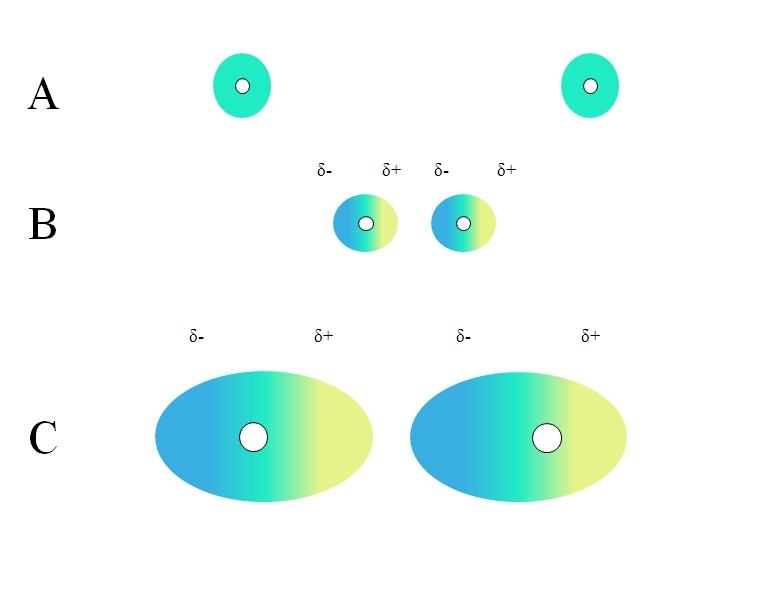
Dos átomos aislados, como los de neón o argón, tienen distribución de carga homogénea. Esto puede apreciarse en A, imagen superior. Los círculos blancos en el centro representan los núcleos, para los átomos, o el esqueleto molecular, para las moléculas. Dicha distribución de carga puede considerarse como una nube de electrones de color verde.
¿Por qué los gases nobles cumplen con esta homogeneidad? Porque tienen su capa electrónica completamente llena, por lo que sus electrones teóricamente deben sentir por igual la carga de atracción del núcleo en todos los orbitales.
En cambio, para otros gases como el oxígeno atómico (O), su capa está incompleta (lo cual se observa en su configuración electrónica) y lo obliga a formar la molécula diatómica O2 para compensar esta deficiencia.
Los círculos verdes de A también pueden tratarse de moléculas, pequeñas o grandes. Su nube de electrones orbita en torno a todos los átomos que la conforman, en especial sobre los más electronegativos. Alrededor de estos átomos la nube se concentrará y será más negativa, mientras que otros átomos tendrán una deficiencia electrónica.
Sin embargo, esta nube no es estática sino dinámica, por lo que en algún momento se formarán breves regiones δ- y δ+, y ocurrirá un fenómeno llamado polarización.
Polarizabilidad
En A la nube de color verde indica una distribución homogénea de carga negativa. No obstante, la fuerza de atracción positiva ejercida por el núcleo puede oscilar sobre los electrones. Esto provoca una deformación de la nube creando así regiones δ-, de color azul, y δ+, de color amarillo.
Este repentino momento dipolar en el átomo o la molécula puede distorsionar una nube electrónica adyacente; en otras palabras, induce un dipolo repentino sobre su vecino (B, imagen superior).
Esto se debe a que la región δ- perturba la nube vecina, sus electrones sienten la repulsión electrostática y se orientan en el polo opuesto, apareciendo δ+.
Nótese cómo se alinean los polos positivos con los negativos, al igual que lo hacen las moléculas con momentos dipolares permanentes. Mientras más voluminosa sea la nube electrónica, con mayor dificultad el núcleo la mantendrá homogénea en el espacio; y además, mayor será la deformación de la misma, tal como se aprecia en C.
Por lo tanto, los átomos y moléculas pequeñas son más improbables de ser polarizadas por cualquier partícula de su entorno. Un ejemplo para esta situación lo ilustra la pequeña molécula de hidrógeno, H2.
Para que condense, o aún más, cristalice, necesita de presiones exorbitantes para obligar a sus moléculas a interactuar físicamente.
Es inversamente proporcional a la distancia
Aunque se formen dipolos instantáneos que induzcan otros a su alrededor, no son suficientes para mantener unidos a los átomos o moléculas.
En B existe una distancia d que separa a las dos nubes y sus dos núcleos. Para que ambos dipolos puedan permanecer por un tiempo considerado, esta distancia d debe ser muy pequeña.
Debe cumplirse esta condición, característica esencial de las fuerzas de London (recordar el cierre velcro), para que surta un efecto notorio en las propiedades físicas de la materia.
Una vez d sea pequeña, el núcleo de la izquierda en B comenzará a atraer la región azul δ- del átomo o molécula vecina. Esto deformará aún más la nube, tal como se aprecia en C (el núcleo ya no está en el centro sino hacia la derecha).
Entonces, llega un punto donde ambas nubes se tocan y “rebotan”, pero a una lentitud lo suficiente para tenerlas unidas un tiempo.
Por lo tanto, las fuerzas de London son inversamente proporcionales a la distancia d. De hecho, el factor es igual a d7, por lo que una mínima variación de la distancia entre ambos átomos o moléculas debilitará o fortalecerá la dispersión de London.
Es directamente proporcional a la masa molecular
¿Cómo aumentar el tamaño de las nubes para que se polaricen con mayor facilidad? Agregando electrones, y para eso el núcleo debe tener más protones y neutrones, aumentando así la masa atómica; o agregando átomos al esqueleto de la molécula, lo que a su vez aumentaría su masa molecular.
De este modo, a los núcleos o el esqueleto molecular se les haría menos probable mantener todo el tiempo uniforme la nube electrónica. Por lo tanto, mientras más grandes sean los círculos verdes considerados en A, B y C, más polarizables serán y mayores serán también sus interacciones por fuerzas de London.
Este efecto se observa claramente entre B y C, y podría serlo aún más si los círculos fueran de mayor diámetro. Este razonamiento es clave para explicar las propiedades físicas de muchos compuestos en función de sus masas moleculares.
Ejemplos de fuerzas de London

En la naturaleza
En la vida diaria hay innumerables ejemplos de las fuerzas de dispersión de London sin necesidad de aventurarse, en primera instancia, al mundo microscópico.
Uno de los ejemplos más comunes y sorprendentes se encuentra en las patas de los reptiles conocidos como gecos (imagen superior) y en muchos insectos (también en Spiderman).
En sus patas tienen unas almohadillas de las cuales sobresalen miles de pequeños filamentos. En la imagen puede apreciarse a un geco posando sobre la pendiente de una roca. Para lograrlo, hace uso de las fuerzas intermoleculares entre la roca y los filamentos de sus patas.
Cada uno de esos filamentos interacciona débilmente con la superficie por la que escala el pequeño reptil, pero dado que son miles de ellos, ejercen una fuerza proporcional al área de sus patas lo suficientemente fuerte para que permanezcan adheridas y puedan escalar. Los gecos también son capaces de escalar superficies lisas y perfectas como las de los cristales.
Alcanos
Los alcanos son hidrocarburos saturados que interactúan también por fuerzas de London. Sus estructuras moleculares consisten simplemente en carbonos e hidrógenos unidos por enlaces simples. Dado que la diferencia de electronegatividades entre C y H es muy pequeña, son compuestos apolares.
Así, el metano, CH4, el hidrocarburo más pequeño de todos, hierve a -161.7º C. Conforme se va agregando C y H al esqueleto, se van obteniendo otros alcanos con mayores masas moleculares.
De esta manera, surgen el etano (-88.6º C), el butano (-0.5º C) y el octano (125.7º C). Nótese cómo aumentan sus puntos de ebullición a medida que los alcanos se vuelven más pesados.
Esto se debe a que sus nubes electrónicas son más polarizables y sus estructuras tienen mayor área superficial, las cuales aumentan el contacto entre sus moléculas.
El octano, aunque es un compuesto apolar, tiene un punto de ebullición mayor que el del agua.
Halógenos y gases
Las fuerzas de London también están presentes en muchas sustancias gaseosas. Por ejemplo, las moléculas de N2, H2, CO2, F2, Cl2 y todos los gases nobles, interactúan mediante estas fuerzas, ya que presentan distribución electrostática homogénea, la cual puede sufrir dipolos instantáneos y dar lugar a polarizaciones.
Los gases nobles son He (helio), Ne (neón), Ar (argón), Kr (kriptón), Xe (xenón) y Rn (radón). De izquierda a derecha sus puntos de ebullición aumentan con el incremento de las masas atómicas: -269, -246, -186, -152, -108, y -62 ºC.
Los halógenos también interactúan mediante estas fuerzas. El flúor es un gas a temperatura ambiente, al igual que el cloro. El bromo, con mayor masa atómica, se encuentra en condiciones normales como un líquido rojizo, y el yodo, para finalizar, forma un sólido morado que sublima rápidamente debido a que es más pesado que los otros halógenos.
Referencias
- Whitten, Davis, Peck & Stanley. Química. (8va ed.). CENGAGE Learning, p 452-455.
- Ángeles Méndez. (22 de mayo de 2012). Fuerzas de dispersión (de London). Recuperado de: quimica.laguia2000.com
- London Dispersion Forces. Recuperado de: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22 de junio de 2018). 3 Types of Intermolecular Forces. Recuperado de: thoughtco.com
- Ryan Ilagan & Gary L Bertrand. London Dispersion Interactions. Tomado de: chem.libretexts.org
- ChemPages Netorials. London Forces. Recuperado de: chem.wisc.edu
- Kamereon. (22 de mayo de 2013). Salamanquesas: El geco y las fuerzas de Van der waals. Recuperado de: almabiologica.com
