Etilenglicol: propiedades, estructura química, usos
El etilenglicol es el compuesto orgánico más simple de la familia de los glicoles. Su fórmula química es C2H6O2, mientras su fórmula estructural es HOCH2-CH2OH. Un glicol es un alcohol caracterizado por tener dos grupos hidroxilos (OH) unidos a dos átomos de carbonos vecinos en una cadena alifática.
El etilenglicol es un líquido claro, incoloro e inodoro. En la imagen de abajo se tiene una muestra de él en un frasco. Además, tiene un sabor dulce y es muy higroscópico. Es un líquido poco volátil, por lo que ejerce una presión de vapor muy pequeña, siendo la densidad del vapor mayor que la densidad del aire.

El etilenglicol es un compuesto de gran solubilidad en el agua, además de ser miscible con muchos compuestos orgánicos; tales como alcoholes alifáticos de cadena corta, acetona, glicerol, etc. Esto se debe a su capacidad de donar y aceptar puentes de hidrógeno de solventes próticos (que tienen H).
El etilenglicol polimeriza en numerosos compuestos, cuyos nombres se suelen abreviar con las siglas PEG y un número que señala su peso molecular aproximado. El PEG 400, por ejemplo, es un polímero relativamente pequeño y líquido. Mientras, que los PEG grandes son sólidos blancos con un aspecto grasoso.
La propiedad del etilenglicol de deprimir el punto de fusión e incrementar el punto de ebullición del agua, permite su uso como refrigerante y anticoagulante en vehículos, aviones y equipos de computación.
Índice del artículo
- 1 Propiedades
- 1.1 Nombres
- 1.2 Masa molar
- 1.3 Apariencia física
- 1.4 Olor
- 1.5 Sabor
- 1.6 Densidad
- 1.7 Punto de fusión
- 1.8 Punto de ebullición
- 1.9 Solubilidad en agua
- 1.10 Solubilidad en otros solventes
- 1.11 Punto de ignición
- 1.12 Densidad del vapor
- 1.13 Presión de vapor
- 1.14 Descomposición
- 1.15 Temperatura de almacenamiento
- 1.16 Calor de combustión
- 1.17 Calor de vaporización
- 1.18 Tensión superficial
- 1.19 Índice de refracción
- 1.20 Constante de disociación
- 1.21 pH
- 1.22 Coeficiente de partición octanol/agua
- 2 Estructura química
- 3 Producción
- 4 Usos
- 5 Intoxicación y riesgos
- 6 Referencias
Etano-1,2-diol (IUPAC), etilenglicol, monoetilenglicol (MEG), 1-2-dihidroxietano.
62,068 g/mol
Líquido claro, incoloro y viscoso.
Inodoro
Dulce
1,1132 g/cm3
-12,9 ºC
197,3 ºC
Miscible con el agua, compuesto muy higroscópico.
Miscible con alcoholes alifáticos inferiores (metanol y etanol), glicerol, ácido acético, acetona y cetonas similares, aldehídos, piridina, bases de alquitrán de hulla y soluble en éter. Prácticamente insoluble en benceno y sus homólogos, hidrocarburos clorados, éter de petróleo y aceites.
111 ºC
2,14 en relación al aire tomado como 1.
0,092 mmHg a 25 ºC (por extrapolación).
Al calentarse a descomposición emite un humo acre e irritante.
2-8 ºC
1.189,2 kJ/mol
50,5 kJ/mol
47,99 mN/m a 25 ºC
1,4318 a 20 ºC
pKa = 14,22 a 25 ºC
6 a 7,5 (100 g/L de agua) a 20 ºC
Log P = – 1,69
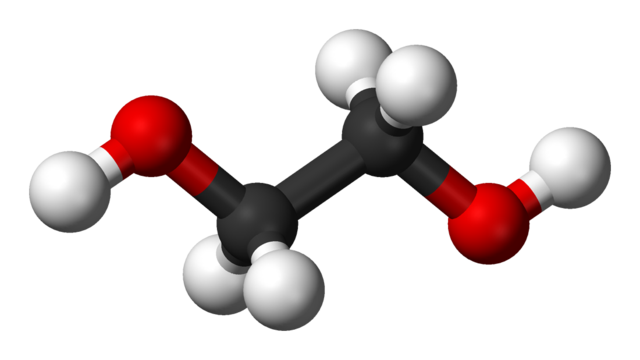
En la imagen superior tenemos la molécula de etilenglicol representada por un modelo de esferas y barras. Las esferas negras corresponden a los átomos de carbono, los cuales conforman su esqueleto C-C, y en sus extremos tenemos las esferas rojas y blancas para los átomos de oxígeno e hidrógeno, respectivamente.
Es una molécula simétrica y a primera vista puede pensarse que desposee un momento dipolar permanente; sin embargo, sus enlaces C-OH rotan, lo cual favorece al dipolo. Es además una molécula dinámica, que experimenta constantes rotaciones y vibraciones, y es capaz de formar o recibir puentes de hidrógeno gracias a sus dos grupos OH.
De hecho, son estas interacciones las responsables de que el etilenglicol tenga un punto de ebullición tan alto (197 ºC).
Cuando la temperatura desciende hasta los -13 ºC, las moléculas cohesionan en un cristal ortorrómbico, donde los rotámeros juegan un papel importante; es decir, hay moléculas que tienen sus grupos O-H orientados en distintas direcciones.
El paso inicial en la síntesis del etilenglicol es la oxidación de etileno a óxido de etileno. Antiguamente, se hacía reaccionar el etileno con ácido hipocloroso para producir la clorhidrina. Luego, esta era tratada con hidróxido de calcio para producir el óxido de etileno.
El método de la clorhidrina es poco rentable y se pasó a un método de oxidación directa del etileno en presencia de aire o de oxígeno, usándose el óxido de plata como catalizador.
La hidrólisis del óxido de etileno (OE) con agua bajo presión produce una mezcla cruda. La mezcla agua-glicol es evaporada y reciclada, separándose por destilación fraccionada el monoetilenglicol del dietilenglicol y del trietilenglicol.
La reacción de hidrólisis del óxido de etileno puede esquematizarse en la forma siguiente:
C2H4O + H2O => OH-CH2-CH2-OH (etilenglicol o monoetilenglicol)
La Mitsubishi Chemical desarrolló un proceso catalítico, mediante el uso de fósforo, en la conversión del óxido de etileno en monoetilenglicol.
En el proceso Omega, el óxido de etileno se convierte inicialmente en carbonato de etileno, a través de su reacción con dióxido de carbono (CO2). Luego, el carbonato de etileno se somete a una hidrólisis catalítica para obtener el monoetilenglicol con un 98% de selectividad.
Existe un método relativamente nuevo para la síntesis de etilenglicol. Este consiste en la carbonilación oxidativa del metanol a dimetil oxalato (DMO) y su subsiguiente hidrogenación a etilenglicol.
La mezcla del etilenglicol con el agua permite una disminución del punto de congelación y un incremento del punto de ebullición, permitiendo que los motores de los automóviles no se congelen en el invierno, ni se recalienten en el verano.
Cuando el porcentaje del etilenglicol en la mezcla con el agua alcanza un 70%, el punto de congelación es de -55 ºC, por lo que la mezcla del etilenglicol-agua puede usarse como líquido de enfriamiento, y de protección contra el congelamiento en aquellas condiciones en que pueda producirse.
Las bajas temperaturas de congelación de las soluciones de etilenglicol permite su uso como anticongelante de motores de automóviles; descongelamiento de las alas de los aviones; y en el deshielo de los parabrisas.
También es utilizado para preservar muestras biológicas conservadas a bajas temperaturas, evitando así la formación de cristales que puedan dañar la estructura de las muestras.
El elevado punto de ebullición permite que las soluciones de etilenglicol sean utilizadas para mantener temperaturas bajas en aparatos o equipos que al funcionar generan calor, tales como: automóviles, equipos de computación, aparatos de aire acondicionado, etc.
El etilenglicol es un compuesto muy higroscópico, lo que ha permitido su uso para tratar los gases extraídos del subsuelo que poseen un alto contenido de vapores de agua. La eliminación del agua de los gases naturales favorece que sean utilizados eficientemente en sus respectivos procesos industriales.
El etilenglicol es usado para la síntesis de polímeros, como los polietilenglicol (PEG), el polietilentereftalato (PET) y el poliuretano. Los PEG son una familia de polímeros usados en aplicaciones tales como: espesamiento de los alimentos, tratamiento del estreñimiento, cosméticos, etc.
El PET se utiliza en la elaboración de todo tipo de envases desechables, los cuales se usan en diferentes tipos de bebidas y alimentos. El poliuretano se usa como aislante térmico en refrigeradores y como relleno en diferentes tipos de muebles.
Es utilizado en la fabricación de la dinamita, permitiendo que al haber un descenso en el punto de congelación de la nitroglicerina, esta pueda ser almacenada con menor riesgo.
El etilenglicol se emplea en el tratamiento de la madera para darle protección contra su pudrición, producida por la acción de los hongos. Esto es importante para la preservación de las obras de artes de los museos.
El etilenglicol está presente en medios para suspender sales conductoras en condensadores electrolíticos y en estabilizadores de la espuma de soya. También se utiliza en la fabricación de plastificantes, elastómeros y ceras sintéticas.
El etilenglicol se emplea en la separación de hidrocarburos aromáticos y parafínicos. Además, se usa en la fabricación de detergentes para la limpieza de equipos. Aumenta la viscosidad y disminuye la volatilidad de la tinta, lo que facilita su uso.
Asimismo, el etilenglicol puede usarse en la fundición de la arena de moldeo y como lubricante durante la molienda de vidrio y cemento. También se utiliza como ingrediente en líquidos de frenado hidráulico e intermediario en la síntesis de ésteres, éteres, fibras de poliéster y resinas.
Entre las resinas en las que se usa como materia prima el etilenglicol está el alquidal, utilizado como base de las pinturas alquidálicas, aplicadas en pinturas automotrices y arquitectónicas.
El etilenglicol tiene baja toxicidad aguda cuando actúa por contacto sobre la piel o si se inhala. Pero, se manifiesta plenamente su toxicidad cuando es ingerido, siendo señalada como la dosis fatal del etilenglicol de 1,5 g/kg de peso corporal, o 100 mL para un adulto de 70 kg.
La exposición aguda al etilenglicol produce los siguientes síntomas: por inhalación origina tos, mareo y dolor de cabeza. En la piel, por contacto con el etilenglicol, se produce resequedad. Mientras, en los ojos produce enrojecimiento y dolor.
La ingestión de etilenglicol se manifiesta por dolor abdominal, náusea, inconsciencia y vómitos. Una ingesta excesiva de etilenglicol tiene un efecto dañino sobre el sistema nervioso central (SNC), el funcionamiento cardiovascular y sobre la morfología y la fisiología renal.
Por fallas en el funcionamiento del SNC se produce parálisis o movimiento irregular ocular (nistagmo). En el sistema cardiopulmonar, se presenta hipertensión arterial, taquicardia y posible insuficiencia cardíaca. Hay alteraciones graves en el riñón, producto de la intoxicación con etilenglicol.
En los túbulos renales se produce dilatación, degeneración y deposición de oxalato de calcio. Esto último se explica por el mecanismo siguiente: el etilenglicol es metabolizado por la enzima deshidrogenasa láctica para producir glicoaldehido.
El glicoaldehido origina los ácidos glicólico, glioxílico y oxálico. El ácido oxálico precipita rápidamente con el calcio para formar oxalato de calcio, cuyos cristales insolubles se depositan en los túbulos renales produciendo alteraciones morfológicas y disfunción en ellos, lo cual puede originar una insuficiencia renal.
Debido a la toxicidad del etilenglicol ha sido reemplazado gradualmente, en algunas de sus aplicaciones, por el propilenglicol.
Los aviones durante su deshielo liberan cantidades importantes de etilenglicol, que terminan acumuladas en las pistas de aterrizajes, las cuales al ser lavadas produce que el agua traslade el etilenglicol, a través del sistema de drenado, hacia los ríos donde su toxicidad afecta la vida de los peces.
Pero no es en sí la toxicidad del etilenglicol la causa principal del daño ecológico. Durante su biodegradación aeróbica se consume una cantidad importante de oxígeno, provocando su disminución en las aguas superficiales.
Por otro lado, su biodegradación anaeróbica se pueden liberar sustancias tóxicas para los peces, como acetaldehído, etanol, acetato y metano.
- Wikipedia. (2019). Ethylene glycol. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. PubChem Database. (2019). 1,2-Ethanediol. CID=174. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Ethylene Glycol: Structure, Formula & Uses. Study. Recuperado de: study.com
- Leroy G. Wade. (27 de noviembre de 2018). Ethylene glycol. Encyclopædia Britannica. Recuperado de: britannica.com
- A. Dominic Fortes & Emmanuelle Suard. (2011). Crystal structures of ethylene glycol and ethylene glycol monohydrate. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24 de diciembre de 2010). Ethylene Glycol (EG) Production and Manufacturing Process. Recuperado de: icis.com
- Lucy Bell Young. (2019). What are the uses of Ethylene Glycol? ReAgent. Recuperado de: chemicals.co.uk
- QuimiNet. (2019). Origen, tipos y aplicaciones de los Etilenglicoles. Recuperado de: quiminet.com
- R. Gomes, R. Liteplo, & M.E. Meek. (2002). Ethylene glycol: Human Health Aspects. World Health Organization Geneva. [PDF]. Recuperado de: who.int
