Hexano (C6H14): propiedades físicas y químicas, estructura, usos, toxicidad
El hexano es un hidrocarburo que se caracteriza por ser un compuesto orgánico cuya fórmula química condensada es C6H14. Se trata de un líquido incoloro, transparente, que no se puede mezclar con el agua. Presenta cinco isómeros, siendo el lineal uno de los hidrocarburos parafínicos más importantes de la industria e investigación.
El hexano se obtiene mediante destilación fraccionada del petróleo crudo. Asimismo, está presente naturalmente en los frutos cítricos y en fracciones volátiles de varias plantas o frutos tales como la manzana, guayaba, avellanas asadas, batata y salvia.
Es un líquido volátil muy inflamable que se encuentra en la gasolina, pegamentos de secado rápido y en cemento de cauchos. El hexano se utiliza como solvente en el proceso de extracción de aceites vegetales, así como de lípidos y grasas presentes en aguas y suelos contaminados.
Las personas que se exponen profesionalmente al hexano, pueden experimentar un daño del sistema nervioso periférico, manifestado por hormigueo y calambres en las piernas y los brazos; además de debilidad muscular generalizada y, en casos severos, atrofia de los músculos esqueléticos.
Índice del artículo
- 1 Propiedades físicas y químicas de los hexanos
- 1.1 Apariencia física
- 1.2 Masa molar
- 1.3 Olor
- 1.4 Umbral de olor
- 1.5 Densidad
- 1.6 Punto de fusión
- 1.7 Punto de ebullición
- 1.8 Punto de ignición
- 1.9 Solubilidad en agua
- 1.10 Solubilidad en solventes
- 1.11 Densidad relativa del vapor con el aire
- 1.12 Coeficiente de partición octanol/agua
- 1.13 Presión de vapor
- 1.14 Longitud de onda de la máxima densidad óptica
- 1.15 Índice de refracción
- 1.16 Viscosidad
- 1.17 Capacidad calórica
- 1.18 Calor de combustión
- 1.19 Calor de vaporización
- 1.20 Tensión superficial
- 1.21 Potencial de ionización
- 1.22 Estabilidad
- 1.23 Reactividad
- 2 Estructura del hexano
- 3 Usos
- 4 Toxicidad
- 5 Referencias
Líquido incoloro, transparente y muy volátil.
86,178 g/mol
Semejante a la gasolina
1,5 ppm
0,6606 g/mL
-96 a -94 ºC
68,5 a 69,1 ºC
-22 ºC (copa cerrada).
9,5 mg/L (prácticamente inmiscible con el agua)
Muy soluble en etanol, soluble en éter etílico y cloroformo. Miscible con alcohol, cloroformo y éter.
2,97 (aire = 1)
Log P = 3,764
17,60 kPa a 20 ºC
200 nm
1,375
0,3 mPa·s
265,2 J·K-1·mol-1
4.163,2 kJ·mol-1
31,56 kJ·mol-1
17,89 mN/m a 25 ºC
10,18 eV
Estable. Incompatible con agentes oxidantes, cloro, flúor, perclorato de magnesio. Forma una mezcla explosiva con el aire.
El hexano puede reaccionar vigorosamente con materiales oxidantes, los cuales pueden incluir cloro líquido, oxígeno concentrado, hipoclorito sódico e hipoclorito de calcio. También es incompatible con tetróxido de dinitrógeno. El hexano puede atacar algunas formas de plásticos, caucho y recubrimientos.
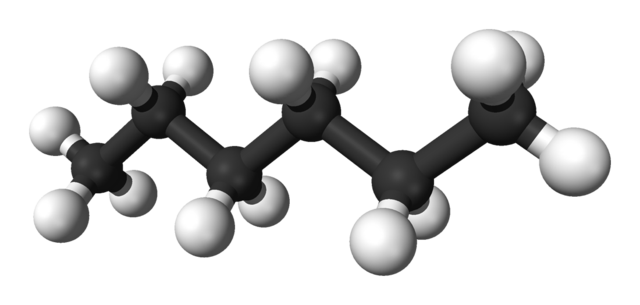
En la primera imagen se muestra la molécula del n-hexano representada por un modelo de esferas y barras. Las esferas negras corresponden a los átomos de carbono, componiendo el esqueleto carbonado zigzagueante, mientras las esferas blancas son los átomos de hidrógeno. El n-hexano es por tanto un hidrocarburo, lineal y altamente dinámico.
Debido a que todos sus enlaces C-H son de baja polaridad, la molécula carece de momento dipolar. Al hacerlo, sus interacciones intermoleculares no son del tipo dipolo-dipolo, sino que dependen exclusivamente de la masa molecular y de las fuerzas dispersivas de London.
Cada molécula de n-hexano “calza” una encima de la otra a muy bajas temperaturas, como se supondría en su estructura cristalina. En cambio, en el líquido sus esqueletos se flexionan y rotan sus enlaces C-H, originando que dicho líquido sea volátil y hierva a 68,7 ºC.
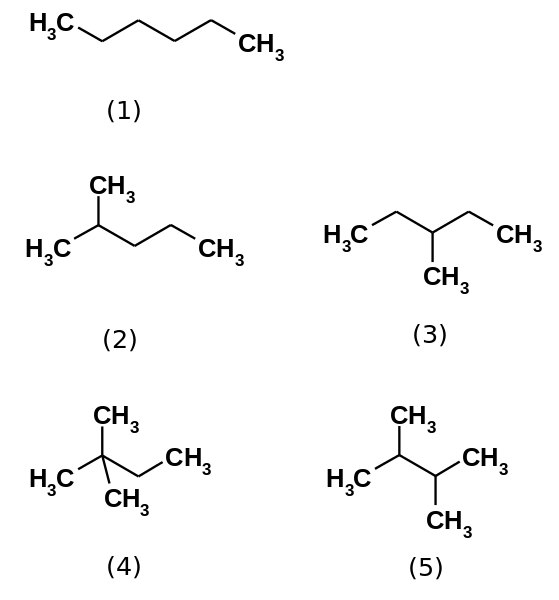
El hidrocarburo hexano consta en realidad de cinco isómeros, siendo el n-hexano el menos ramificado, (1). Los otros cuatro isómeros son, en orden creciente:
2-metilpropano (2)
3-metilpropano (3)
2,2-dimetilbutano (4)
2,3-dimetilbutano (5)
Nótese además que las estructuras se tornan más ramificadas de (1) a (5). Al estar más ramificadas, las fuerzas dispersivas disminuyen, pues ya no hay porciones lineales que calcen eficientemente. Esto conlleva a una disminución y variación de los puntos de ebullición de los isómeros; aunque se observan ciertas discrepancias aceptables.
Tanto el 2-metilpropano (peb = 60,3 ºC) como el 3-metilpropano (peb = 63,3 ºC) están igualmente ramificados, pero sus puntos de ebullición son diferentes. Luego le sigue el 2,3-dimetilbutano (peb = 58 ºC), para finalmente ubicarse el 2,2-dimetilbutano como el líquido más volátil (peb = 49,7 ºC).
El hexano se mezcla con productos químicos similares para producir solventes. Entre los nombres que reciben estos solventes están hexano comercial, hexanos mixtos, etc. Ellos se usan como agentes de limpieza en la industria textil, de muebles y en la impresión de huecograbado.
El hexano es un ingrediente de los pegamentos usados en la impermeabilización de los techos, en el calzado y en el cuero. También se usa para encuadernar libros, para moldear pastillas y tabletas, enlatar, fabricar neumáticos y pelotas de beisbol.
El hexano se utiliza en la determinación del índice de refracción de minerales y líquido de relleno para los termómetros en lugar del mercurio; generalmente con un tinte rojo o azul. Igualmente se usa en la extracción de grasa y aceite del agua para el análisis de sus contaminantes.
El hexano se utiliza como solvente en la extracción de aceite de semillas de vegetales, tales como la soya, la canola o el merey. Además, se usa para desengrasar piezas de diferentes orígenes. Se utiliza en la desnaturalización del alcohol, en el método de análisis HPLC y en espectrofotometría.
La toxicidad aguda del hexano es relativamente baja, aunque es un anestésico leve. La exposición aguda a altas concentraciones de hexano puede producir por inhalación, depresión leve del sistema nervioso central (SNC), la cual se manifiesta por mareos, vértigo, náuseas leves y dolor de cabeza.
Asimismo, puede originar dermatitis y la irritación de los ojos y la garganta. La inhalación crónica de hexano, relacionada con la actividad laboral, puede provocar un daño en el sistema nervioso periférico (polineuropatía sensomotora).
Los síntomas iniciales son hormigueo y calambres en las piernas y en los brazos, seguidos de debilidad muscular. En los casos severos, se puede presentar una atrofia de la musculatura esquelética, conjuntamente con pérdida de coordinación y problemas de visión.
La toxicidad del hexano está relacionada con la generación del metabolito hexano-2,5-diona. Este reacciona con el aminoácido lisina de una cadena lateral proteica, produciendo la pérdida de la función de la proteína.
La Enviromental Protection Agency (EPA) calculó una concentración de referencia (RfC) para el hexano de 0,2 mg/m3, y una dosis de referencia (RfD) de 0,06 mg/kg de peso/día.
En las décadas de 1960 y 1970 se produjo en un grupo de trabajadores de la industria de la elaboración de calzados de Japón, la presencia de alteraciones nerviosas. La causa era que respiraban en una atmósfera de hexano de 500 – 2.500 ppm, durante 8-14 horas por día.
Los trabajadores presentaban los síntomas conocidos de la inhalación crónica de hexano, descubriendo los médicos que los nervios que controlaban los músculos de los brazos y las piernas estaban dañados.
- Danielle Reid. (2019). Hexane: Structure, Formula & Properties. Study. Recuperado de: study.com
- National Center for Biotechnology Information. (2019). Hexane. PubChem Database. CID=8058. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Hexane. Recuperado de: en.wikipedia.org
- World of Molecules. (s.f.). Hexane molecule. Recuperado de: worldofmolecules.com
- Chemical Book. (2017). Hexane. Recuperado de: chemicalbook.com
- Commonwealth of Australia. (s.f.). n-Hexane: Sources of emissions. Recuperado de: npi.gov.au
- EPA. (2000). Hexane. [PDF]. Recuperado de: epa.gov
- Agency for Toxic Substances and Disease Registry. (1999). Public Health Statement for n-Hexane. Recuperado de: atsdr.cdc.gov
