Yoduro de plata (AgI): estructura, propiedades, obtención, usos
El yoduro de plata es un compuesto inorgánico formado por un átomo de plata (Ag) y uno de yodo (I), donde este posee una valencia de -1 y la plata de +1. Su fórmula química es AgI.
Es un sólido cristalino amarillo claro que se oscurece al estar expuesto largo tiempo a la luz. Es casi insoluble en agua, pero se disuelve en presencia de una alta concentración de ion yoduro (I–).

Por poseer una estructura cristalina semejante al hielo se ha empleado como semilla para producir lluvias y cambiar el clima. Este uso ha sido cuestionado debido al daño potencial que puede causar el AgI al disolverse en el agua.
Desde el siglo XIX fue utilizado en fotografía por su capacidad de oscurecerse con la luz. También se emplea en terapias antimicrobianas.
Recientemente se ha estudiado su uso en la remoción de yodo radiactivo de desechos producidos en la generación de energía nuclear. Es útil en fibras ópticas.
Es un compuesto tóxico para humanos, animales y plantas.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Uso en la modificación del clima
- 6 Uso en fotografía
- 7 Uso en la remoción de yodo radiactivo
- 8 Otros usos
- 9 Riesgos
- 10 Referencias
Es un compuesto iónico formado por plata en su estado de oxidación +1 y yodo con valencia -1. El enlace entre los dos iones es muy fuerte y estable.
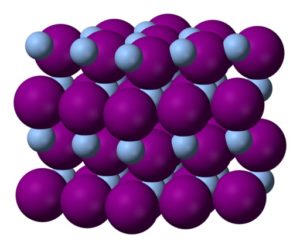
Su estructura cristalina depende de la temperatura. Por debajo de 137 °C se encuentra en la forma cúbica o gamma (γ-AgI), entre 137 y 145,8 °C es un sólido amarillo verdoso o forma beta (β-AgI) y por encima de 145,8 °C presenta un color amarillo y es su forma alfa (α-AgI).
- Yoduro de plata
Sólido amarillo claro, cristales hexagonales o cúbicos.
234,773 g/mol
558 ºC
1506 ºC
5,68 g/cm3
Prácticamente insoluble en agua: 28×10-7 g/L a 25 °C (0,0000028 g/L). Insoluble en ácidos excepto en ácido yodhídrico (solución de yoduro de hidrógeno en agua). Soluble en soluciones concentradas de bromuros alcalinos y cloruros alcalinos.
Los ácidos concentrados a altas temperaturas (hirviendo) lo atacan lentamente. Sin embargo, las soluciones calientes de hidróxidos alcalinos no lo afectan.
Se disuelve en soluciones en las que hay exceso de ion yoduro (I-) formando un complejo de yodo y plata.
Es sensible a la luz, se oscurece lentamente pues forma plata metálica.
En la naturaleza se encuentra en forma del mineral yodargirita, que es la forma β-AgI.

En el laboratorio se puede preparar calentando una solución de nitrato de plata (AgNO3) con una solución de un yoduro alcalino, como yoduro de potasio (KI). Precipita el AgI y se lava en ausencia de luz con agua hirviendo.
AgNO3 + KI → AgI↓ + KNO3
Es aplicado a las nubes para cambiar la cantidad o tipo de precipitación, desencadenar procesos de granizo, dispersar nieblas frías y debilitar huracanes.
Se dispersa como semilla en nubes frías que contienen agua líquida superenfriada (temperaturas por debajo de 0 °C). Su estructura cristalina similar al hielo favorece la congelación del agua superenfriada.

Después de su dispersión como semilla en las nubes, el AgI se encuentra dentro del interior de la nube y es lavado por la precipitación.
La presencia de yoduro de plata soluble en el agua de lluvia es algo a tomar en cuenta, pues es un compuesto tóxico para plantas y animales tanto acuáticos como terrestres y humanos.

La siembra de nubes de manera repetitiva sobre una misma área puede conducir a un efecto acumulativo de este compuesto. La Agencia de Protección del Ambiente, o EPA (del inglés Environmental Protection Agency) considera al AgI un contaminante de agua y suelos.
Según estudios realizados en 2013, la concentración de yoduro de plata hallada en zonas donde se ha utilizado esta técnica es mucho mayor que el límite a partir del cual es tóxico para algunos peces y organismos inferiores.
El AgI es un material capaz de reaccionar en presencia de luz, por lo que se emplea en la obtención de materiales fotosensibles como los rollos fotográficos, sobre los cuales se aplican sus cristales.
El tamaño de estos cristales, también denominados granos, es lo que define la magnitud de la fotosensibilidad. A mayor tamaño de grano, mayor sensibilidad a la luz y por ende se requiere menor cantidad de esta para captar la imagen.
El papel fotográfico posee una capa delgada de gelatina en la cual están suspendidos los granos de AgI.
La estructura cristalina de este compuesto es tal que permite cierto movimiento de electrones, por lo que al incidir o impactar un fotón en el cristal se libera un electrón, el cual se combina con un ion plata cercano formando plata metálica (Ag0).
Cristal de AgI + fotón → e–
Ag+ + e– → Ag0
El efecto de los fotones sobre la emulsión fotográfica es reducir el ion plata a plata metálica, formando la imagen latente, la cual es invisible a simple vista, pero posee ocultas las diferencias de luminosidad de la escena capturada.

Es decir, algunas zonas del rollo fotográfico han recibido fotones y otras no. Para evitar que la emulsión siga reaccionando se protege el material de la acción de la luz y luego se adicionan compuestos químicos para fijar la imagen y hacer que esta sea visible.
El metal plata creará las áreas oscuras debido a su color.
Aunque en la actualidad podemos obtener rápidamente imágenes fotográficas con nuestros teléfonos inteligentes, los procesos químicos de fotografía aún son parte fundamental en películas cinematográficas y película para rayos X, entre otras aplicaciones.
Debido a su insolubilidad el AgI ha sido propuesto en un mecanismo para remover yodo o yoduro radiactivo contenido en desechos acuosos generados por las estaciones de energía nuclear.
Según estudios realizados en 2019 las nanopartículas de plata con zeolita tienen la habilidad de remover el yodo del agua. En presencia de agua las nanopartículas de Ag contenidas en la zeolita se oxidan formando Ag2O, luego se genera el ion Ag+ el cual se une al yoduro y precipita el AgI sobre la superficie de la zeolita.

Se ha empleado para tratar infecciones de las membranas mucosas de animales en forma de suspensiones coloidales con 5-49% en peso. En situaciones de inflamación de ojos, oídos y nariz se aplica en forma de ungüento o pomada al 5%.
Las nanopartículas de AgI se han empleado como agentes para terapias antimicrobianas. En laboratorios químicos y bioquímicos se usa como reactivo y sirve como intermediario en la preparación de otros compuestos de plata y yodo.
Ha sido estudiado por los físicos por poseer un mecanismo de conducción de electricidad tipo enrejado líquido. Se emplea en fibras ópticas para láser infrarrojo pues es transparente en la región media e infrarroja del espectro de luz.
Es tóxico para el ser humano a través de todas las rutas, como contacto dérmico, inhalación e ingestión. Produce erupciones en la piel, conjuntivitis, decoloración grisácea de la piel, la conjuntiva y órganos internos, dolor de cabeza, fiebre, laringitis y bronquitis.
La interacción con compuestos de cobre puede aumentar el potencial mutagénico del AgI.
Es un compuesto muy tóxico para la vida acuática y terrestre, tanto animales como plantas. Sus efectos dañinos pueden perdurar en el ambiente.
- U.S. National Library of Medicine. (2019). Silver Iodide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Curic, M. and Janc, D. (2013). Wet deposition of the seeding agent after weather modification activities. Environ Sci Pollut Res 20, 6344-6350 (2013). Recuperado de link.springer.com.
- Witten, N.M. (2016). The Chemistry of Photography. Senior Thesis. University of South Carolina. Columbia. Recuperado de scholarcommons.sc.edu.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Tauanov, Z. and Inglezakis, V.J. (2019). Removal of iodide from water using silver nanoparticles-impregnated synthetic zeolites. Science of the Total Environment 682 (2019) 259-270. Recuperado de sciencedirect.com.
- Wikimedia Foundation. (2020). Silver iodide. Recuperado de en.wikipedia.org.
- Matsuura, Y. (2013). Optical fibers for medical applications. In Lasers for Medical Applications. Recuperado de sciencedirect.com.
