Bromuro de plata (AgBr): estructura, propiedades y usos
El bromuro de plata es una sal inorgánica cuya fórmula química es AgBr. Su sólido se compone de cationes Ag+ y aniones Br– en una proporción 1:1, atraídos por fuerzas electrostáticas o por enlaces iónicos. Se puede ver como si la plata metálica hubiera cedido uno de sus electrones de valencia al bromo molecular.
Su naturaleza se asemeja a sus “hermanos” cloruro y yoduro de plata. Las tres sales son insolubles en agua, tienen colores similares y, además, son sensibles a la luz; esto es, sufren reacciones fotoquímicas. Esta propiedad ha sido empleada en la obtención de fotografías, fruto de la reducción de los iones Ag+ a plata metálica.
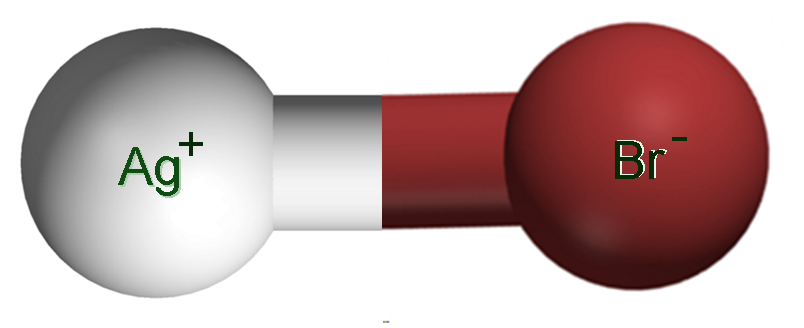
En la imagen superior se muestra un par iónico Ag+Br–, en el cual las esferas de color blanco y marrón corresponden a los iones Ag+ y Br–, respectivamente. Aquí representan al enlace iónico como Ag-Br, pero es necesario indicar que no hay tal enlace covalente entre ambos iones.
Puede parecer contradictorio que la plata sea quien aporte el color negro de las fotografías sin color. Esto se debe a que el AgBr reacciona con la luz, generando una imagen latente; la cual, luego, se intensifica mediante el incremento de la reducción de la plata.
Índice del artículo
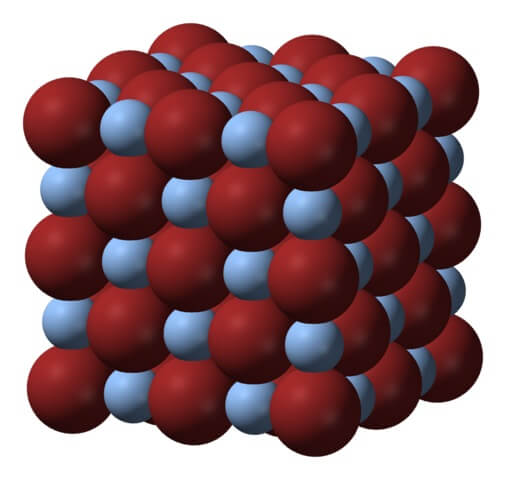
Arriba se tiene la red o estructura cristalina del bromuro de plata. Aquí se muestra una representación más fiel de la diferencia de tamaño entre los radios iónicos de Ag+ y Br–. Los aniones Br–, más voluminosos, dejan intersticios donde se sitúan los cationes Ag+, el cual está rodeado de seis Br– (y viceversa).
Esta estructura es característica de un sistema cristalino cúbico, específicamente de tipo sal gema; el mismo, por ejemplo, que para el cloruro de sodio, NaCl. De hecho, la imagen facilita esto al disponer un límite cúbico perfecto.
A primera vista puede notarse que hay cierta diferencia de tamaño entre los iones. Esto, y quizás las características electrónicas del Ag+ (y del posible efecto de algunas impurezas), conlleva a que los cristales de AgBr presenten defectos; es decir, sitios donde se “rompe” la secuencia de ordenamiento de los iones en el espacio.
Estos defectos consisten en vacíos dejados por iones ausentes o desplazados de lugar. Por ejemplo, entre seis aniones Br– normalmente debe estar el catión Ag+; pero en lugar de ello, puede haber un vacío debido a que la plata se haya desplazado hacia otro intersticio (defecto de Frenkel).
Aunque afecten la red cristalina, favorecen las reacciones de la plata con la luz; y mientras más grande sean los cristales o el cúmulo de los mismos (tamaño de granos), mayor será el número de defectos, y por lo tanto, será más sensible a la luz. Asimismo, las impurezas influyen en la estructura y en esta propiedad, en especial las que puede reducirse con los electrones.
Como consecuencia de esto último, los cristales grandes de AgBr requieren de menor exposición a la luz para reducirse; es decir, son más deseables para fines fotográficos.
En el laboratorio se puede sintetizar el bromuro de plata mezclando una solución acuosa de nitrato de plata, AgNO3, con la sal bromuro de sodio, NaBr. La primera sal aporta la plata, y la segunda el bromuro. Lo que sigue a continuación es una reacción de doble desplazamiento o metátesis que puede representarse con la ecuación química de abajo:
AgNO3(aq) + NaBr(s) => NaNO3(aq) + AgBr(s)
Nótese que la sal nitrato de sodio, NaNO3, es soluble en agua, mientras que el AgBr precipita como un sólido con un color amarillo tenue. Posteriormente el sólido se lava y se somete a desecación al vacío. Además del NaBr, también pudiera utilizarse KBr como fuente de aniones bromuros.
Por otro lado, naturalmente puede obtenerse el AgBr mediante su mineral bromirita y sus debidos procesos de purificación.
Sólido de color amarillo blancuzco parecido a una arcilla.
187,77 g/mol.
6,473 g/mL.
432°C.
1502°C.
0,140 g/mL a 20°C.
2,253.
270 J/Kg·K.
Se dijo en el apartado anterior que en los cristales de AgBr hay defectos que promueven la sensibilidad de esta sal a la luz, ya que atrapan los electrones formados; y así, en teoría, se evita que reaccionen con otras especies en el medio, como por ejemplo, el oxígeno del aire.
El electrón se libera de la reacción del Br– con un fotón:
Br– + hv => 1/2Br2 + e–
Nótese que se produce Br2, el cual teñirá de rojo el sólido si no se le retira. Los electrones liberados reducen los cationes Ag+, en sus intersticios, a plata metálica (representada a veces como Ag0):
Ag+ + e– => Ag
Teniendo entonces la ecuación neta:
AgBr => Ag + 1/2Br2
Cuando se forman las “primeras capas” de plata metálica sobre la superficie, se dice que se tiene una imagen latente, invisible todavía para el ojo humano. Esta imagen se hace millones de veces más visible si otra especie química (como la hidroquinona y fenidona, en el proceso de revelado) incrementa la reducción de los cristales de AgBr a plata metálica

El bromuro de plata es el más utilizado de todos sus haluros en el terreno de revelación de películas fotográficas. Se aplica el AgBr sobre dichas películas, hechas con acetato de celulosa, suspendido en una gelatina (emulsión fotográfica), y en presencia de 4-(metilamino)fenol sulfato (Metol) o fenidona, e hidroquinona.
Con todos estos reactivos, se puede dar vida a la imagen latente; terminar y acelerar la transformación de la plata iónica a la metálica. Pero, si no se procede con ciertos cuidados y experiencia, toda la plata de la superficie se oxidará, y acabará el contraste entre los colores negro y blanco.
Es por eso que son vitales los pasos de bañado de paro, fijación y lavado, de las películas fotográficas.
Hay artistas que juegan con estos procesos de tal manera que crean matices de grises, los cuales enriquecen la belleza de la imagen y de su propio legado; y todo esto lo hacen, a veces quizás sin sospecharlo, gracias a reacciones químicas, cuya base teórica puede llegar a ser un poco compleja, y a un AgBr sensible a la luz y que marca un punto de partida.
- Wikipedia. (2019). Silver bromide. Recuperado de: en.wikipedia.org
- Michael W. Davidson . (13 de noviembre de 2015). Polarized Light Digital Image Gallery: Silver Bromide. Olympus. Recuperado de: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Silver bromide (AgBr). Recuperado de: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann, and Claudia Schneeweiss. (29 de junio de 2004). Self-made silver-bromide-based emulsions for users in holography: manufacturing, processing, and application, Proc. SPIE 5290, Practical Holography XVIII: Materials and Applications; doi: 10.1117/12.525035; https://doi.org/10.1117/12.525035
- Alan G. Shape. (1993). Química inorgánica. (Segunda edición.). Editorial Reverté.
- Carlos Güido y Ma Eugenia Bautista. (2018). Introducción a la química fotográfica. Recuperado de: fotografia.ceduc.com.mx
- García D. Bello. (09 de enero de 2014). Química, fotografía y Chema Madoz. Recuperado de: dimetilsulfuro.es
