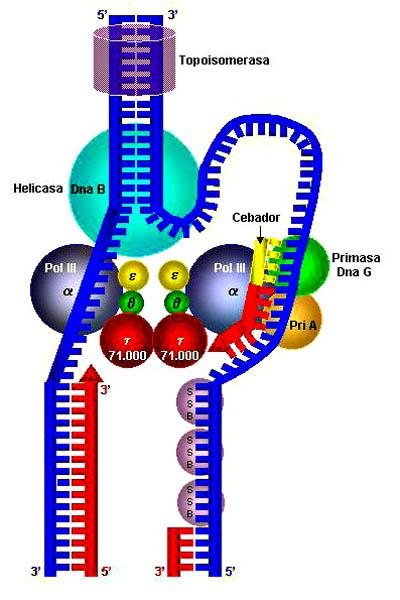
Helicasa: características, estructuras y funciones
La helicasa hace referencia a un grupo de enzimas del tipo proteica-hidrolítica muy importantes para todos los organismos vivos; también son llamadas proteínas motoras. Estas se trasladan por el citoplasma celular, convirtiendo energía química en trabajo mecánico mediante hidrólisis de ATP.
Su función más importante es romper los puentes de hidrógeno entre las bases nitrogenadas de los ácidos nucleicos, permitiendo así su replicación. Es importante recalcar que las helicasas son prácticamente ubicuas, puesto que están presentes en virus, bacterias y en organismos eucariotas.
La primera de estas proteínas o enzimas fue descubierta en el año 1976 en la bacteria Escherichia coli; dos años después se descubrió la primera helicasa en un organismo eucariotico, en plantas de lirios.
Actualmente han sido caracterizadas proteínas helicasas en todos los reinos naturales incluyendo a los virus, lo que implica que se ha generado un vasto conocimiento sobre estas enzimas hidrolíticas, sus funciones en los organismos y su rol mecanicista.
Índice del artículo
Las helicasas son macromoléculas biológicas o naturales que aceleran reacciones químicas (enzimas). Se caracterizan principalmente por separar complejos químicos de adenosín trifosfato (ATP) por medio de hidrólisis.
Dichas enzimas utilizan el ATP para unirse y remodelar complejos de ácidos desoxirribonucleicos (ADN) y ácidos ribonucleicos (ARN).
Existen al menos 2 tipos de helicasas: las ADN y las ARN.
Las ADN helicasas actúan en la replicación del ADN y se caracterizan por separar el ADN de cadenas dobles en cadenas simples.
Estas enzimas actúan en los procesos metabólicos del ácido ribonucleico (ARN) y en la multiplicación, reproducción o biogénesis ribosomal.
La ARN helicasa también es clave en el proceso de empalme previo del ARN mensajero (ARNm) y el inicio de la síntesis de proteínas, después de la transcripción de ADN a ARN en el núcleo celular.
Estas enzimas pueden ser diferenciadas según su homología en la secuenciación de aminoácidos del dominio central de aminoácidos ATPasa, o por motivos de secuenciación compartidos. Según la clasificación, estas están agrupadas en 6 superfamilias (SF 1-6):
Las enzimas de esta superfamilia presentan una polaridad de translocación 3′-5′ o 5′-3′ y no forman estructuras anulares.
Es conocido como el grupo más amplio de helicasas y lo componen principalmente ARN helicasas. Presentan una polaridad de translocación generalmente de 3′-5′ con muy pocas excepciones.
Tienen nueve motivos (del inglés motifs, que se traduce como “elementos recurrentes”) de secuencias de aminoácidos altamente conservados y, al igual que los SF1, no forman estructuras anulares.
Son helicasas características de virus y tienen una polaridad de translocación única de 3′-5′. Poseen solo cuatro motivos de secuencia altamente conservados y forman estructuras anulares o anillos.
Fueron descritos por primera vez en bacterias y bacteriófagos. Son un grupo de helicasas replicantes o replicativas.
Tienen una polaridad de translocación única de 5′-3′, y tienen cinco motivos de secuencia altamente conservados. Estas helicasas se caracterizan porque forman anillos.
Son proteínas del tipo factor Rho. Las helicasas de la superfamilia SF5 son características de organismos procariontes y son hexaméricas dependientes del ATP. Se piensa que están muy relacionadas con las SF4; además, presentan formas anulares y no anulares.
Son proteínas aparentemente relacionadas con la superfamilia SF3; sin embargo, las SF6 presentan un dominio de proteínas ATPasas asociadas a diversas actividades celulares (proteínas AAA) no presentes en SF3.
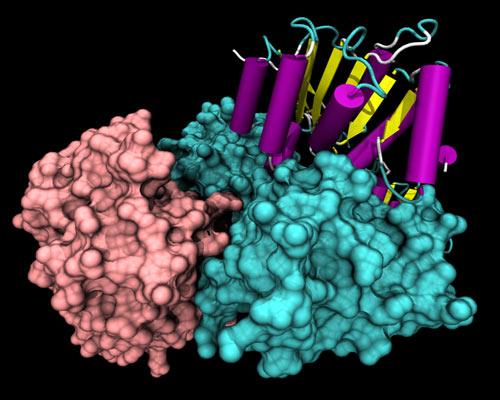
Estructuralmente, todas las helicasas tienen motivos de secuencia altamente conservados en la porción anterior de su estructura primaria. Una porción de la molécula presenta una disposición de los aminoácidos particular que depende de la función específica de cada helicasa.
Las helicasas más estudiadas estructuralmente son las de la superfamilia SF1. Se sabe que estas proteínas se agrupan en 2 dominios muy parecidos a las proteínas multifuncionales RecA, y estos dominios forman un bolsillo de unión ATP entre ellos.
Las regiones no conservadas pueden presentar dominios específicos del tipo de reconocimiento de ADN, dominio de localización celular y de proteína-proteína.
Las funciones de estas proteínas dependen de una importante variedad de factores, entre los que destacan el estrés ambiental, el linaje de las células, los antecedentes genéticos y las etapas del ciclo celular.
Se sabe que las ADN helicasas de la SF1 cumplen funciones específicas en la reparación, replicación, trasferencia y recombinación del ADN.
Separan cadenas de una doble hélice del ADN y participan en el mantenimiento de los telómeros, en reparaciones por rotura de la doble hebra y en la eliminación de proteínas asociadas a los ácidos nucleicos.
Como fue mencionado previamente, las ARN helicasas son vitales en la gran mayoría de los procesos metabólicos del ARN, y también se conoce que estas proteínas participan en la detección de ARN viral.
Además, actúan en la respuesta inmunitaria antiviral, ya que detectan ARN extraños o ajenos al organismo (en vertebrados).
Las helicasas ayudan a las células a superar el estrés endógeno y exógeno, evitando la inestabilidad cromosómica y manteniendo el equilibrio celular.
La falla de este sistema o equilibrio homeostático está relacionada con mutaciones genéticas que implican genes que codifican proteínas del tipo helicasas; por esta razón son objeto de estudios biomédicos y genéticos.
A continuación mencionaremos algunas de las enfermedades relacionadas con mutaciones en genes que codifican ADN como proteínas de tipo helicasa:
Es una enfermedad genética originada por una mutación de un gen denominado WRN, que codifica una helicasa. La helicasa mutante no actúa correctamente y ocasiona una serie de enfermedades que, en conjunto conforman, el síndrome de Werner.
La principal característica de los que padecen esta patología es su envejecimiento prematuro. Para que se manifieste la enfermedad el gen mutante debe heredarse de ambos progenitores; su incidencia es muy baja y no existe tratamiento para su cura.
El síndrome de Bloom es una enfermedad genética producto de la mutación de un gen autosómico denominado BLM que codifica una proteína helicasa. Solo se presenta para individuos homocigotos para ese carácter (recesivo).
La característica principal de esta rara enfermedad es la hipersensibilidad a luz solar, que ocasiona lesiones en la piel del tipo rash eritromatoso. Aún no existe cura.
También es conocido como poiquilodermia atrófica congénita. Es una patología de origen genético muy poco frecuente: hasta la fecha existen menos de 300 casos descritos en el ámbito mundial.
Se origina por una mutación del gen RECQ4, un gen autosómico y de manifestación recesiva que se ubica en el cromosoma 8.
Los síntomas o padecimientos de este síndrome incluyen cataratas juveniles, anomalías en el sistema esquelético, despigmentación, dilataciones capilares y atrofia en la piel (poiquilodermia). En algunos casos pueden presentarse hipertiroidismo y deficiencia en la producción de testosterona.
- R.M. Brosh (2013). DNA helicases involved in DNA repair and their roles in cancer. Nature Reviews Cancer.
- Helicase. Recuperado de nature.com.
- Helicase. Recuperado de en.wikipedia.org.
- A. Juárez, L.P. Islas, A.M. Rivera, S.E. Tellez, M.A. Duran (2011). Síndrome de Rothmund-Thompson (poiquilodermia atrofica congénita) en mujer gestante. Clínica e Investigación en Ginecología y Obstetricia.
- K.D. Raney, A.K. Byrd, S. Aarattuthodiyil (2013). Structure and Mechanisms of SF1 DNA Helicases. Advances in Experimental Medicine and Biology.
- Síndrome de Bloom. Recuperado de medicina.ufm.edu.
- M. Singleton, M.S. Dillingham, D.B. Wigley (2007). Structure and mechanism of Helicases and Nucleic Acid Translocases. Annual Review of Biochemistry.
