Calmodulina: estructura, funciones y mecanismo de acción
Calmodulina es un término que viene a significar “proteína modulada por calcio”, y se refiere a una pequeña proteína intracelular que tiene la propiedad de unirse al ión calcio (Ca++) y de mediar muchas de sus acciones intracelulares. El origen de la palabra nace de la combinación de las palabras en inglés ‘calcium’, ‘modulated’ y ‘protein’ que, al juntarse, deriva en CALcium MODULated proteIN.
Entre los elementos minerales que entran a formar parte de la constitución de los organismos animales, el calcio, seguido del fósforo, es con mucha diferencia el más abundante, puesto que el hueso se forma por la deposición en su matriz de grandes cantidades de sales minerales formadas a partir de este ión.
Por supuesto que estas sales minerales de calcio son esenciales para la constitución y conformación del sistema esquelético de los vertebrados, pero es la forma ionizada del calcio (Ca++) en solución en los líquidos corporales la que cobra una importancia fisiológica relevante para la vida de los organismos.
Este catión, con dos cargas eléctricas positivas en exceso en su estructura, puede actuar como transportador de corriente al moverse a través de la membrana celular y modificar su nivel de potencial eléctrico en muchas de las células excitables del organismo, principalmente en el músculo cardíaco.
Pero de mayor relevancia fisiológica es el hecho de que muchas reacciones regulatorias celulares disparadas por estímulos externos, como neurotransmisores, hormonas u otros factores físicos o bioquímicos, son especies de cascadas metabólicas en las que participan secuencialmente varias proteínas, algunas de las cuales son enzimas que requieren del calcio para su activación o inactivación.
Se dice entonces en estos casos que el calcio actúa como segundo mensajero en una cascada metabólica destinada a tener un resultado final que vendría a ser como la respuesta celular necesaria para satisfacer una necesidad detectada en otro nivel distinto al de la célula misma, y que requiere de ella esa respuesta en particular.
El calcio puede actuar de manera directa sobre su blanco bioquímico para influir en su actividad, pero requiere muchas veces de la participación de una proteína con la cual debe unirse para poder ejercer su efecto sobre la(s) proteína(s) a modificar. La calmodulina es una de esas proteínas mediadoras.
Índice del artículo
- 1 Estructura
- 2 Funciones de la calmodulina
- 3 Mecanismo de acción
- 4 Calmodulina en las plantas
- 5 Referencias
La calmodulina, de una gran ubicuidad, puesto que se expresa en casi todos los tipos celulares de los organismos eucariotas, es una pequeña proteína acídica de unos 17 kDa de peso molecular, cuya estructura está sumamente conservada entre las especies.
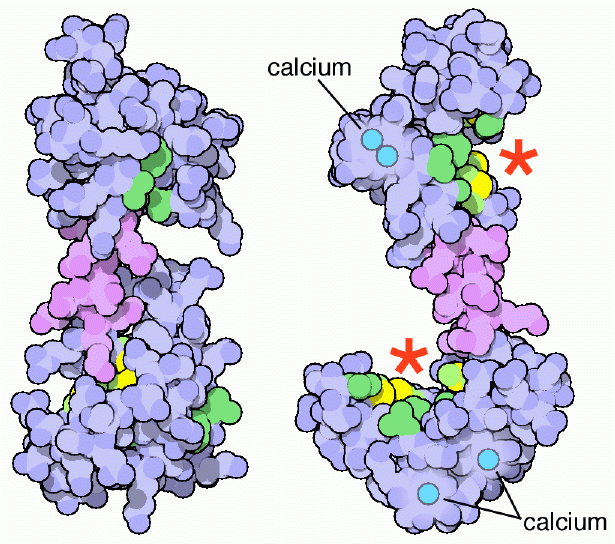
Es una proteína monomérica, es decir, está formada por una sola cadena polipeptídica, que adopta en sus extremos terminales la forma de dominios globulares unidos entre sí por una hélice alfa. Cada dominio globular tiene dos motivos conocidos como mano EF (del inglés EFhand) que son típicos de las proteínas que se unen al calcio.
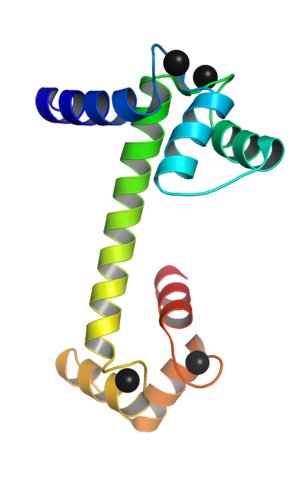
Estos motivos topológicos de “mano EF” representan una especie de estructuras supersecundarias; están unidos entre sí, en cada dominio globular, por una región de gran flexibilidad y en cada uno de ellos hay un sitio de unión para el Ca++, lo cual arroja 4 sitios en total para cada molécula de calmodulina.
La unión de los iones de calcio, con carga positiva, es posible gracias a la presencia de residuos aminoacídicos con cadenas laterales cargadas negativamente en los sitios de unión al calcio de la calmodulina. Estos residuos son tres aspartatos y un glutamato.
Todas las funciones hasta ahora conocidas para la calmodulina están enmarcadas dentro de un grupo de acciones promovidas por los incrementos de calcio citosólico producidos por su entrada desde el espacio extracelular o su salida desde los depósitos intracelulares: mitocondrias y retículo endoplásmico.
Muchas de las acciones del calcio las cumple este ión actuando directamente sobre sus proteínas blanco, que pueden ser de índoles y funciones diversas. Algunas de esas proteínas no pueden ser influidas de manera directa, sino que requieren que el calcio se una a la calmodulina y sea este complejo el que actúe sobre la proteína influida por el ión.
Se dice de estas proteínas blanco que son calcio-calmodulina dependientes y entre ellas se incluyen decenas de enzimas, como proteincinasas, proteinfosfatasas, nucleótido ciclasas y fosfodiesterasas; implicadas todas ellas en un sinnúmero de funciones fisiológicas que incluyen:
– El metabolismo
– El transporte de partículas
– La movilidad visceral
– La secreción de sustancias
– La fertilización de los óvulos
– La expresión genética
– La proliferación celular
– La integridad estructural de las células
– La comunicación intercelular, etc.
Entre las proteincinasas dependientes de calmodulina se citan: la cinasa de cadena ligera de miosina (MLCK), la fosforilasa cinasa, y las Ca++/calmodulina cinasas I, II y III.
Así pues, la información codificada por las señales de calcio (aumento o disminución de su concentración intracelular) es “descifrada” por esta y otras proteínas de unión al calcio, que convierten las señales en cambios bioquímicos; en otras palabras, la calmodulina es una proteína intermediaria en los procesos de señalización calcio-dependientes.
La calmodulina es una proteína muy versátil, pues sus proteínas “diana” son considerablemente diversas en forma, secuencia, tamaño y función. Puesto que es una proteína que funciona como “sensor” de iones de calcio, su mecanismo de acción depende de los cambios inducidos en su estructura y/o conformación una vez se une a cuatro de estos iones.
Sus mecanismos de acción se pueden ejemplificar revisando brevemente su participación en un par de procesos fisiológicos como la contracción del músculo liso visceral y la adaptación a los olores que sufren las células ciliadas de la mucosa olfatoria en la nariz.
La contracción de los músculos esquelético y cardíaco se desencadena cuando el incremento de Ca++ citosólico alcanza niveles por encima de 10-6 mol/l y este ión se une a la troponina C, que sufre cambios alostéricos que afectan a la tropomiosina. A su vez, tropomiosina se mueve y deja al descubierto en la actina sus sitios de unión con la miosina, derivando en que el proceso contráctil se dispare.
En el músculo liso no existe troponina C, y el incremento de Ca++ por encima del nivel señalado promueve su unión con la calmodulina. El complejo Ca-calmodulina activa a la cinasa de cadena ligera de miosina (MLCK), la cual a su vez fosforila a esta cadena ligera, activa a la miosina y dispara el proceso contráctil.
El incremento del Ca++ se da por su entrada desde afuera o su salida desde el retículo sarcoplásmico por acción del inositol trifosfato (IP3) liberado por la fosfolipasa C en la cascada activada por receptores acoplados a proteína Gq. La relajación ocurre cuando el Ca++, por acción de transportadores, es retirado del citosol y vuelve a sus sitios de origen.
Una diferencia importante entre ambos tipos de contracción es que en los músculos estriados (cardíaco y esquelético) el Ca++ induce cambios alostéricos al unirse con su proteína, la troponina, mientras que en el liso los cambios producidos por la Ca-calmodulina son covalentes e implican la fosforilación de la miosina.
Por eso, una vez terminada la acción del Ca++, se requiere la participación de otra enzima que retire el fosfato añadido por la cinasa. Esta nueva enzima es la fosfatasa de la cadena ligera de miosina (MLCP) cuya actividad no depende de la calmodulina, sino que es regulada por otras vías.
En realidad, el proceso contráctil del músculo liso no cesa del todo, sino que el grado de contracción se mantiene en un nivel intermedio resultado del balance de las acciones de ambas enzimas, la MLCK controlada por el Ca++ y la calmodulina, y la MLCP sometida a otros controles regulatorios.
La sensación olorosa se dispara cuando se activan unos receptores olfatorios ubicados en los cilios de unas células ubicadas en la superficie de la mucosa olfatoria.
Esos receptores están acoplados a una proteína G heterotrimérica conocida como “Golf” (proteína G olfatoria), que posee tres subunidades: “αolf”, “ß” y “γ”.
Cuando los receptores olfatorios se activan en respuesta a un olor, las subunidades de esta proteína se disocian y la subunidad “αolf” activa a la enzima adenilciclasa, produciendo adenosín monofosfato cíclico (AMPc).
El AMPc activa unos canales de tipo CNG (activados por nucleótidos cíclicos) para calcio y sodio. Estos iones entran a la célula, la despolarizan y provocan el inicio de potenciales de acción cuya frecuencia determinará la intensidad del olor.
El calcio que entra, que tiende a despolarizar a la célula, tiene un efecto antagónico de retroalimentación negativa, algo más tardío, al unirse a la calmodulina y entre ambos cerrar el canal y eliminar el estímulo despolarizante, a pesar de que el estímulo oloroso persista. A eso se le llama adaptación de los sensores.
La plantas también responden a las diferencias de concentración intracelulares de los iones de calcio por medio de la proteína calmodulina. En estos organismos, las calmodulinas comparten muchas características estructurales y funcionales con sus homólogas en animales y levaduras, aunque difieren en algunos aspectos funcionales.
Por ejemplo, la calmodulina en las plantas se une a secuencias peptídicas cortas dentro de sus proteínas blanco, induciendo cambios estructurales que alteran sus actividades en respuesta a las variaciones internas de calcio.
Hasta qué punto la calmodulina controla en las plantas procesos análogos a los que ocurren en los animales, es algo que sigue siendo tema de discusión en la actualidad.
- Brenner B: Musculatur, in: Physiologie, 6th ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Celular & Molecular Basis of Medical Physiology, in: Review of Medical Physiology, 25th ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Introduction to endocrinology, in: Textbook of Medical Physiology, 13th ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4th ed; P Deetjen et al (eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, in: Physiologie, 6th ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, R. E. (1998). Calmodulin and calmodulin-binding proteins in plants. Annual review of plant biology, 49(1), 697-725.
