Tipos de pilas, características y reacciones
En el mercado se puede conseguir distintos tipos de pilas con sus características propias. Las pilas, que no son más que celdas voltaicas, aportan al consumidor la ventaja de llevar consigo a cualquier lugar (siempre que las condiciones no sean drásticas) energía eléctrica.
Generalmente las pilas pueden comprarse aisladas; pero, también se consiguen acopladas unas con otras en series o paralelo, cuyo conjunto viene a ser lo que denominan baterías. Y es así que en ocasiones los términos ‘pilas’ y ‘baterías’ suelen usarse indiscriminadamente, aun cuando no sean lo mismo.

Las pilas pueden tener innumerables colores, formas y tamaños, al igual que pueden estar hechas de otros materiales. Asimismo, y más importante, su estructura interna, donde se desarrollan las reacciones químicas que generan electricidad, sirve para diferenciarlas unas de otras.
Por ejemplo, en la imagen superior se muestra tres pilas alcalinas, una de las más comunes. El término alcalino se refiere a que el medio donde se produce la liberación y flujo de electrones, es básico; es decir, tiene un pH mayor a 7 y predominan los aniones OH– y otras cargas negativas.
Índice del artículo
Antes de abordar algunos de los diferentes tipos de pilas que hay, es necesario saber que estas se clasifican globalmente como primarias o secundarias.
Las pilas primarias son aquellas que una vez consumidas, deben desecharse o reciclarse, ya que la reacción química sobre la que se sustenta la corriente eléctrica es irreversible. Por lo tanto, estas no pueden recargarse.
Se utilizan principalmente en aplicaciones donde resulte impráctico recargar la energía eléctrica; tales como en dispositivos militares, en pleno campo de batalla. Asimismo, están diseñadas para equipos que consuman poca energía, para que así duren más; por ejemplo, los controles remotos o consolas portátiles (tipo Gameboy, tetris y tamagotchi).
Las pilas alcalinas, para citar otro ejemplo, también pertenecen al tipo primarias. Usualmente suelen tener formas cilíndricas, aunque esto no implica que las pilas cilíndricas no puedan ser secundarias o recargables.
A diferencia de las pilas primarias, las secundarias sí pueden recargarse una vez se hayan quedado sin energía.
Esto se debe a que las reacciones químicas que ocurren dentro de ellas son reversibles, y por tanto, tras aplicárseles cierto voltaje, ocasiona que las especies producto se transformen nuevamente en reactivo, para iniciar así otra vez la reacción.
Algunas pilas secundarias (llamadas baterías) suelen ser pequeñas, al igual que las primarias; sin embargo, se destinan a dispositivos que consumen más energía y para los cuales resultaría poco práctico económica y energéticamente el uso de las pilas primarias. Por ejemplo, las baterías de los teléfonos celulares contienen pilas secundarias.
Asimismo, las pilas secundarias están diseñadas para equipos o circuitos grandes; por ejemplo, las baterías de los automóviles, la cual está compuesta por varias pilas o celdas voltaicas.
Son por lo general más costosas que las pilas y baterías primarias, pero para usos a largo plazo terminan siendo una opción más adecuada y efectiva.
Las pilas se clasifican ya sea en primarias o secundarias; pero comercial o popularmente, suelen clasificárseles de acuerdo a la forma (cilíndricas, rectangulares, de botones), al dispositivo destinado (cámaras, vehículos, calculadoras), a sus nombres (AA, AAA, C, D, N, A23, etc.), y a sus códigos IEC y ANSI.
Asimismo, características como su voltaje (1,2 a 12 voltios), al igual que su tiempo de vida útil y precios, se encargan de conferirles cierta clasificación a los ojos del consumidor.
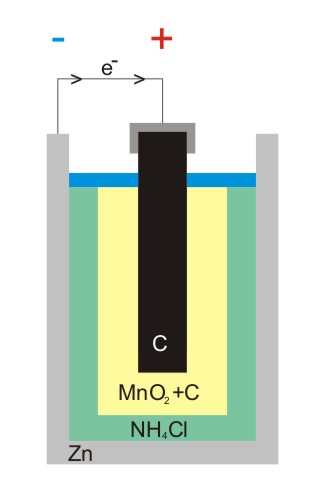
Las pilas de carbono-zinc (también conocidas como celdas de Leclanché o pilas salinas) son una de las más primitivas, y actualmente se consideran casi en desuso frente a otras pilas; en especial, frente a las pilas alcalinas, las cuales aunque son un poco más costosas, tienen un tiempo de vida y voltajes mayores.
Como su nombre indica, sus electrodos consisten de una lata de zinc y una vara de grafito, correspondientes al ánodo y cátodo, respectivamente.
En el primer electrodo, el ánodo, se originan los electrones mediante la oxidación del zinc metálico. Estos electrones seguidamente recorren un circuito externo que alimenta al dispositivo con energía eléctrica, y después terminan en el cátodo de grafito, donde se completa el ciclo al reducirse el dióxido de manganeso en el que está sumergido.
Reacciones
Las ecuaciones químicas para las reacciones que ocurren en los electrodos son:
Zn(s) → Zn2+(ac) + 2e– (Ánodo)
2 MnO2(s) + 2e– + 2 NH4Cl(ac) → Mn2O3(s) + 2 NH3(ac) + H2O (l) + 2 Cl– (ac) (Cátodo)
Estas pilas son muy parecidas a las alcalinas: ambas son cilíndricas (tales como las de la imagen). Sin embargo, las pilas de carbono-zinc pueden distinguirse si se lee detalladamente las características rotuladas en el exterior, o si su código IEC es precedido por la letra R. Su voltaje es de 1,5 V.
Las pilas alcalinas son muy parecidas a las del tipo carbono-zinc, con la diferencia de que el medio donde se encuentran los electrodos contiene aniones OH–. Dicho medio consiste de electrolitos fuertes de hidróxido de potasio, KOH, el cual aporta los OH– que participan y “colaboran” en la migración de los electrones.
Viene en diferentes tamaños y voltajes, aunque el más común es de 1,5V. Son quizás las pilas más conocidas en el mercado (Duracell, por ejemplo).
Las reacciones que ocurren en sus electrodos son:
Zn(s) + 2OH−(aq) → ZnO(s) + H2O(l) + 2e− (Ánodo)
2MnO2(s) + H2O(l) + 2e− → Mn2O3(s) + 2OH−(aq) (Cátodo)
A medida que aumenta la temperatura, con mayor rapidez ocurren las reacciones y más rápido se descargan las pilas. Curiosamente, se corrió rumores populares de meterlas en el congelador para aumentar su tiempo de vida; pero, al enfriarse, su contenido puede sufrir posibles solidificaciones que traigan consigo posteriores defectos o riesgos.
Mercurio

Las pilas de mercurio son muy características por su peculiar forma de botones plateados (imagen superior). Casi todo el mundo las reconocería a primera vista. También son alcalinas, pero su cátodo incorpora, además de grafito y dióxido de manganeso, óxido de mercurio, HgO; el cual, tras reducirse, se transforma en mercurio metálico:
Zn(s) + 2OH–(ac) → ZnO(s) + H2O(l) + 2e–
HgO(s) + H2O + 2e– → Hg(s) + 2OH–
Nótese cómo en estas reacciones de celda se consumen y regeneran los aniones OH–.
Al ser pilas pequeñas, se destina a artefactos pequeños, como relojes, calculadoras, controles de juguetes, etc. Quien haya usado cualquiera de estos objetos se habrá percatado que no es necesario cambiarles las pilas por casi una “eternidad”; la cual equivaldría a 10 años, aproximadamente.
Óxido de plata

El principal defecto de las pilas de mercurio es que al ser desechadas representan un serio problema para el medio ambiente, debido a las características tóxicas de dicho metal. Quizás se deba a esto que carece de códigos IEC y ANSI. Para las pilas de óxido de plata, su código IEC es precedido por la letra S.
Uno de los sustitutos para las pilas de mercurio corresponde a la de óxido plata, mucho más costosa, pero de menor impacto ecológico (imagen superior). En sus inicios contenían mercurio para proteger el zinc de la corrosión alcalina.
Viene disponible con un voltaje de 1,5V, y sus aplicaciones son muy similares a las de la pila de mercurio. De hecho, a simple vista ambas pilas lucen idénticas; aunque puede haber pilas de óxido de plata mucho más grandes.
Las reacciones en sus electrodos son:
Zn(s) + 2OH−(ac) → Zn(OH)2(s) + 2 e−
Ag2O(s) + 2H+(ac) + 2e− → 2Ag(s) + H2O(l)
El agua posteriormente sufre electrólisis, descomponiéndose en iones H+ y OH–.
Nótese que en lugar de mercurio, se forma en el cátodo plata metálica.

A partir de este punto se consideran las pilas secundarias o baterías. Al igual que la de mercurio, las pilas de níquel-cadmio son dañinas para el medio ambiente (para la fauna y la salud) por el metal cadmio.
Se caracterizan por generar altas corrientes eléctricas y pueden recargarse un gran número de veces. De hecho, pueden recargarse en total 2000 veces, lo que es igual a una durabilidad extraordinaria.
Sus electrodos consisten de hidróxido óxido de níquel, NiO(OH), para el cátodo, y cadmio metálico para el ánodo. El fundamento químico, en esencia, sigue siendo el mismo: cadmio (en lugar del zinc) pierde electrones, y el cadmio NiO(OH) los gana.
Las reacciones de semiceldas son:
Cd(s) + 2OH–(ac) → Cd(OH)2(s) + 2e–
2NiO(OH)(s) + 2H2O(l) + 2e– → 2Ni(OH)2(s) + OH–(ac)
Los aniones OH–, nuevamente, provienen del electrolito KOH. Las pilas NiCad, pues, terminan generando hidróxidos metálicos de níquel y cadmio.
Se usan de manera individual o acoplada en paquetes (como el de color amarillo, imagen superior). Vienen, pues, en paquetes grandes o pequeños. Los pequeños encuentran uso en juguetes; pero los grandes, se destinan a aeronaves y vehículos eléctricos.

Otra pila o batería muy conocida, y que supera en capacidades energéticas a la de NiCad, es la de Ni-HM (níquel e hidruro metálico). Puede venir en formato cilíndricos (las pilas convencionales, imagen superior), o acopladas en una batería.
Químicamente presente casi las mismas características que las pilas NiCad, con principal diferencia radicando en su electrodo negativo: el cátodo no es de cadmio, sino de una aleación intermetálica de tierras raras y metales de transición.
Esta aleación se encarga de absorber el hidrógeno formado durante la carga, generando un hidruro metálico complejo (de ahí la letra H en su nombre).
Si bien las pilas Ni-HM aportan más energía (aproximadamente 40% más), son más costosas, se desgastan con mayor rapidez, y no pueden recargarse el mismo número de veces que las pilas NiCad; es decir, tienen un tiempo de vida útil menor. Sin embargo, carecen del efecto memoria (pérdida de rendimiento de las pilas al no descargarse completamente).
Es por esta razón que no deben usarse en maquinarias que trabajan a largo plazo; aunque este problema se ha apaliado con las pilas LSD-NiHM. Asimismo, las pilas o baterías Ni-HM presentan características térmicas muy estables, siendo operables en un amplio rango de temperaturas sin representar un riesgo.
Reacciones
Las reacciones que ocurren en sus electrodos son:
Ni(OH)2(s) + OH−(ac) ⇌ NiO(OH)(s) + H2O(l) + e−
H2O(l) + M(s) + e− ⇌ OH−(ac) + MH(s)

En las pilas y baterías con litio se basan en la migración de los iones Li+, los cuales se transfieren desde el ánodo al cátodo, producto de las repulsiones electrostáticas por la creciente carga positiva.
Algunas pueden recargarse, como las baterías de las laptop (imagen superior), y otras, las pilas cilíndricas y rectangulares (de LiSO2, LiSOCl2 o LiMnO2) no.
Las pilas de ion-litio se caracterizan por ser muy ligeras y energéticas, lo que les permite usarse en muchos dispositivos electrónicos, como teléfonos inteligentes y equipos médicos. Asimismo, sufren apenas del efecto memoria, su densidad de carga supera a las de las pilas y baterías NiCad y Ni-HM, y demora más en descargarse.
No obstante, son muy sensibles a las altas temperaturas, llegando incluso a explotar; y además, suelen ser más costosas frente a otras pilas. Aun así, en el mercado las pilas de litio son vistas con buenos ojos, y muchos consumidores las califican como las mejores.

Y finalmente, la bacteria de plomo ácido, como su nombre indica, no contiene iones OH– sino H+; específicamente, una solución concentrada de ácido sulfúrico. Las celdas voltaicas se encuentran en el interior de sus cajas (imagen superior), donde tres o seis de ellas pueden estar acopladas en series, dando una batería de 6 o 12 V, respectivamente.
Es capaz de generar grandes cantidades de carga eléctrica, y debido a que son muy pesadas, se destinan a aplicaciones o dispositivos que no puedan transportarse manualmente; por ejemplo, los automóviles, paneles solares y submarinos. Esta batería ácida es la más antigua y todavía sigue estando vigente en la industria automotriz.
Sus electrodos están hechos de plomo: PbO2 para el cátodo, y plomo metálico esponjoso para el ánodo. Las reacciones que ocurren en ellos son:
Pb(s) + HSO−4(aq) → PbSO4(s) + H+(aq) + 2e−
PbO2(s) + HSO−4(aq) + 3H+(aq) + 2e− → PbSO4(s) + 2H2O(l)
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Odunlade Emmanuel. (24 de julio de 2018). Different types of batteries and their applications. Circuit Digest. Recuperado de: circuitdigest.com
- PRBA. (s.f.). Types of batteries. Recuperado de: prba.org
- Isidor Buchman. (2019). What’s the best battery? Battery University. Recuperado de: batteryuniversity.com
- The McGraw-Hill Companies. (2007). Chapter 12: Batteries. [PDF]. Recuperado de: oakton.edu
- Shapley Patricia. (2012). Common battery types. University of Illinois. Recuperado de: butane.chem.uiuc.edu
- Actitud Ecológica. (22 de enero de 2017). Tipos de pilas: guía completa con las pilas y baterías que existen. Recuperado de: actitudecologica.com
