LDH: funciones, determinación, reacción, valores normales
La lactato deshidrogenasa, ácido láctico deshidrogenasa, lactato deshidrogenasa NAD-dependiente o simplemente LDH, es una enzima perteneciente al grupo de las oxidorreductasas que se encuentra prácticamente en todos los tejidos animales, vegetales y en muchos microorganismos como las bacterias, las levaduras y las arqueas.
Las enzimas de este tipo se denotan con el número EC 1.1.1.27 del comité de nomenclatura enzimática y se encargan de la reacción que convierte el lactato a piruvato (por oxidación) y viceversa (por reducción), oxidando o reduciendo dinucleótidos de nicotinamida adenina (NAD+ y NADH) en el proceso conocido como fermentación láctica.
A diferencia de la fermentación alcohólica, que ocurre solo en algunos microorganismos como las levaduras y que emplea el piruvato glucolítico para la producción de etanol, la fermentación láctica tiene lugar en muchos organismos y tejidos del cuerpo de diferentes seres vivos.
Esta importante enzima para el metabolismo celular fue cristalizada a partir de músculo esquelético de ratas en la década de 1940 y, hasta la fecha, las mejor caracterizadas son la del músculo esquelético y la del tejido cardíaco en mamíferos.
En los animales “superiores” la enzima emplea el isómero L del lactato (L-lactato) para la producción de piruvato, pero algunos animales “inferiores” y bacterias producen D-lactato a partir del piruvato obtenido por glucólisis.
La lactato deshidrogenasa suele expresarse mayoritariamente en tejidos o células bajo condiciones anaeróbicas (de baja irrigación sanguínea) que, en los seres humanos, por ejemplo, pueden caracterizar condiciones patológicas como cáncer, afecciones hepáticas o cardíacas.
Sin embargo, la conversión del piruvato en lactato es propia de los músculos durante el ejercicio y la córnea del ojo, que es pobremente oxigenada.
Índice del artículo
- 1 Funciones
- 2 Características y estructura
- 3 Determinación
- 4 Reacción
- 5 Valores normales
- 6 ¿Qué significa tener un LDH alto?
- 7 Referencias
La lactato deshidrogenasa cumple múltiples funciones en numerosas rutas metabólicas. Es el centro del delicado equilibrio entre las rutas catabólicas y anabólicas de los carbohidratos.
Durante la glucólisis aeróbica, el piruvato (el último producto de la ruta per se) puede ser empleado como sustrato del complejo enzimático piruvato deshidrogenasa, por quien es descarboxilado, liberándose moléculas de acetil-CoA que son empleadas aguas abajo, metabólicamente hablando, en el ciclo de Krebs.
En la glucólisis anaeróbica, por el contrario, el último paso de la glucólisis produce piruvato, pero este es empleado por la lactato deshidrogenasa para producir lactato y NAD+, que restituye el NAD+ que fue empleado durante la reacción catalizada por la gliceraldehído 3-fosfato deshidrogenasa.
Como durante la anaerobiosis la fuente principal de producción de energía en forma de ATP es la glucólisis, la lactato deshidrogenasa tiene un papel fundamental en la reoxidación del NADH producido en pasos previos de la ruta glucolítica, esencial para el funcionamiento de otras enzimas relacionadas.
La lactato deshidrogenasa también está implicada en la glucogénesis que tiene lugar en los tejidos que convierten el lactato en glucógeno y, en algunos tejidos aeróbicos como el corazón, el lactato es un combustible que se reoxida para producir energía y poder reductor en forma de ATP y NAD+, respectivamente.
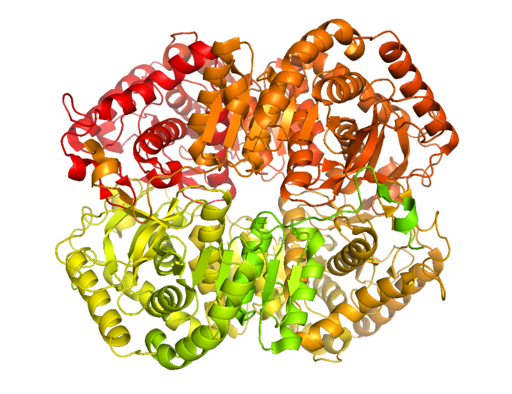
Existen múltiples formas moleculares de lactato deshidrogenasa en la naturaleza. Solamente en los animales se ha determinado que existen cinco actividades lactato deshidrogenasa, todas tetraméricas y compuestas esencialmente por dos tipos de cadenas polipeptídicas conocidas como las subunidades H y M (pudiendo ser homo- o heterotetraméricas).
La forma H se encuentra típicamente en tejido cardíaco, mientras que la forma M ha sido detectada en el músculo esquelético. Ambas cadenas difieren entre sí en cuanto a abundancia, composición aminoacídica, propiedades cinéticas y propiedades estructurales.
Las formas H y M son el producto traduccional de genes diferentes, posiblemente ubicados en cromosomas distintos, y que también están bajo el control o la regulación de genes diferentes. La forma H es predominante en tejidos con metabolismo aeróbico y la forma M en tejidos anaeróbicos.
Otro tipo de nomenclatura emplea las letras A, B y C para los distintos tipos de enzimas tanto en mamíferos como en aves. Así, la lactato deshidrogenasa muscular se conoce como A4, la cardíaca como B4 y una tercera se denomina C4, que es específica de los testículos.
La expresión de estas isoenzimas está regulada tanto en forma estadio de desarrollo-dependiente como tejido-dependiente.
La enzima ha sido aislada de diferentes fuentes animales y se ha determinado que su estructura tetramérica tiene un peso molecular promedio de unos 140 kDa y que el sitio de unión para el NADH o en NAD+ consta de una lámina β-plegada compuesta por seis cadenas y 4 hélices alfa.
La actividad lactato deshidrogenasa de origen animal es determinada espectrofotométricamente in vitro mediante mediciones de cambio de coloración gracias al proceso de oxidorreducción que tiene lugar durante la reacción de conversión de piruvato a lactato.
Las mediciones se realizan a 340nm con un espectrofotómetro y se determina la tasa de disminución de densidad óptica debida a la oxidación o “desaparición” del NADH, que es convertido a NAD+.
Es decir, la reacción determinada es como sigue:
Piruvato + NADH + H+ → Lactato + NAD+
La medición enzimática debe realizarse en óptimas condiciones de pH y concentración de sustratos para la enzima, de manera que no se corra el riesgo de subestimar la cantidad presente en las muestras por déficit de sustratos o por condiciones extremas de acidez o basicidad.
Otro método, quizá un tanto más moderno, para la determinación de la presencia de lactato deshidrogenasa tiene que ver con el uso de herramientas inmunológicas, es decir, con el uso de anticuerpos.
Estos métodos aprovechan la afinidad entre la unión de un antígeno con un anticuerpo generado específicamente contra este y son muy útiles para la determinación rápida de la presencia o ausencia de enzimas como la LDH en un tejido particular.
Dependiendo de la finalidad, los anticuerpos empleados deberán ser específicos para la detección de alguna de las isoenzimas o para cualquier proteína con actividad lactato deshidrogenasa.
La determinación de esta enzima se realiza con diferentes propósitos, pero principalmente para el diagnóstico clínico de algunas condiciones entre las que destacan el infarto de miocardio y el cáncer.
A nivel celular, la liberación de la lactato deshidrogenasa ha sido considerada como uno de los parámetros para determinar la ocurrencia de procesos necróticos o apoptóticos, puesto que la membrana plasmática se hace permeable.
Los productos de la reacción que cataliza también pueden ser determinados en un tejido en aras de determinar si en el mismo predomina un metabolismo anaeróbico por algún motivo en especial.
Como se comento inicialmente, la enzima lactato deshidrogenasa, cuyo nombre sistemático es (S)-lactato: NAD+ deshidrogenasa, cataliza la conversión de lactato en piruvato de forma NAD+ dependiente, o viceversa, lo que se da gracias a la transferencia de un ion hidruro (H–) desde el piruvato al lactato o desde el NADH hacia el piruvato oxidado.
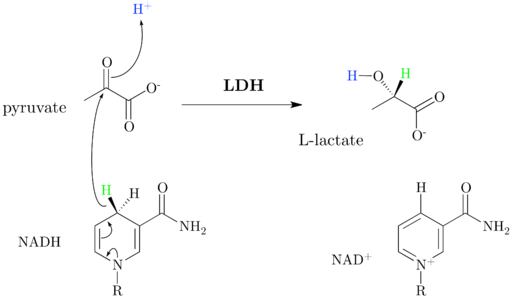
El NAD+ posee una unidad de ADP y otro grupo nucleotídico derivado del ácido nicotínico, denominado también niacina o vitamina B3, y esta coenzima participa en múltiples reacciones de gran importancia biológica.
Es importante resaltar que el equilibrio en dicha reacción está desplazado hacia el lado correspondiente al lactato y se ha demostrado que la enzima también es capaz de oxidar otros ácidos (S)-2-hidroximonocarboxílicos y emplear, aunque menos eficientemente, NADP+ como sustrato.
Dependiendo de la región corporal que se considere y, al mismo tiempo, de sus características metabólicas en relación con la presencia o la ausencia de oxígeno, los tejidos producen cantidades diferentes de lactato, el producto de la reacción catalizada por la LDH.
Si se considera, por ejemplo, un glóbulo rojo (eritrocito) que carece de mitocondrias que puedan metabolizar el piruvato producido durante la glucólisis a CO2 y agua, entonces podría decirse que estas son las principales células productoras de lactato en el cuerpo humano, puesto que todo el piruvato es convertido a lactato por acción de la lactato deshidrogenasa.
En cambio, si se consideran las células del hígado y las células del músculo esquelético, estas son responsables de la producción de una mínima cantidad de lactato, en vista de que este es metabolizado rápidamente.
La concentración de lactato deshidrogenasa en el suero sanguíneo es producto de la expresión de varias isoenzimas en el hígado, el corazón, el músculo esquelético, los eritrocitos, y tumores, entre otros.
En el suero sanguíneo los rangos normales de actividad de la lactato deshidrogenasa están entre las 260 y las 850 U/ml (unidades por mililitro), con un valor promedio de 470±130 U/ml. Entretanto, los hemolizados sanguíneos tienen una actividad LDH que varía entre 16.000 y 67.000 U/ml, lo que equivale a un promedio de 34.000±12.000 U/ml.
La cuantificación de la concentración de lactato deshidrogenasa en el suero sanguíneo tiene un importante valor en el diagnóstico de algunas enfermedades cardíacas, hepáticas, sanguíneas e incluso cánceres.
Elevadas cifras de actividad LDH se han encontrado en pacientes con infartos al miocardio (tanto experimentales como clínicos), así como en pacientes cancerosos, concretamente en mujeres con cáncer endometrial, de ovarios, de seno y de útero.
Dependiendo de la isoenzima particular que se halle en “exceso” o en una alta concentración, la cuantificación de las isoenzimas de la lactato deshidrogenasa es empleada por muchos médicos tratantes para la determinación de lesiones en los tejidos (graves o crónicas).
- Bergmeyer, H., Bernt, E., & Hess, B. (1961). Lactic Dehydrogenase. Methods of Enzymatic Analysis. Verlag Chemie, GmbH.
- Chung, F., Tsujubo, H., Bhattacharyya, U., Sharief, F., & Li, S. (1985). Genomic organization of human lactate dehydrogenase-A gene. Biochemical Journal, 231, 537–541.
- De Becker, D. (2003). Lactic acidosis. Intensive Care MEd, 29, 699–702.
- Everse, J., & Kaplan, N. (1973). Lactate Dehydrogenases: Structure and Function. In Advances in Enzymology and Related Areas of Molecular Biology (pp. 61–133).
- Fox, S. I. (2006). Human Physiology (9th ed.). New York, USA: McGraw-Hill Press.
- Huijgen, H., Sanders, G. T. B., Koster, R. W., Vreeken, J., & Bossuyt, P. M. M. (1997). The Clinical Value of Lactate Dehydrogenase in Serum : A Quantitative Review. Eur J Clin Chem Clin Biochem, 35(8), 569–579.
- Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). (2019). Retrieved from www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Biochemistry. Burlington, Massachusetts: Neil Patterson Publishers.
- Usategui-Gomez, M., Wicks, R. W., & Warshaw, M. (1979). Immunochemical Determination of the Heart Isoenzyme of Lactate Dehydrogenase (LDH1) in Human Serum. Clin Chem, 25(5), 729–734.
- Wróblewski, F., & Ladue, J. S. (1955). Lactic Degydrogenase Activity in Blood. Experimental Biology and Medicine, 90, 210–215.
