Sulfato de manganeso (MnSO4): estructura, propiedades, obtención, usos
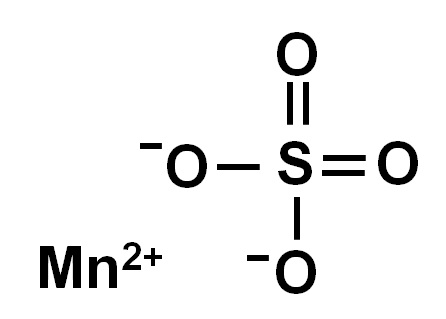
El sulfato de manganeso (II) es un sólido inorgánico formado por los elementos manganeso (Mn), azufre (S) y oxígeno (O). Su fórmula química es MnSO4. Su forma anhidra (sin agua en su estructura) es un sólido blanco. Sin embargo, posee varias formas hidratadas y todas ellas son sólidos de color rosado.
El sulfato de manganeso en cantidades muy pequeñas (ínfimas) es utilizado como micronutriente tanto para animales como para humanos, pues se requiere para el funcionamiento normal del organismo.

También se agrega junto con ciertos fertilizantes en suelos deficientes en manganeso (Mn) para cultivos agrícolas que lo necesitan, como por ejemplo las plantas de uva.
Por la coloración rosada de sus variedades hidratadas se utiliza en pigmentos que sirven para pintar cerámicas, colorear telas y otros materiales. Además sirve para obtener otros compuestos de manganeso.
El MnSO4 debe manipularse con cuidado. Su inhalación puede causar problemas respiratorios y producir graves inconvenientes en el sistema nervioso, que incluyen síntomas similares a la enfermedad de Parkinson.
Su exceso puede también causar daño a animales terrestres y acuáticos y plantas.
Índice del artículo
El sulfato de manganeso anhidro (sin agua en su estructura cristalina) está formado por un ion manganeso en estado de oxidación +2, es decir, Mn2+ y un anión sulfato SO42-.
- Sulfato de manganeso (II)
- Monosulfato de manganeso
- Sulfato de manganeso anhidro MnSO4
- Sulfato de manganeso monohidratado MnSO4•H2O
- Sulfato de manganeso tetrahidratado MnSO4•4H2O
- Sulfato de manganeso pentahidratado MnSO4•5H2O
- Sulfato de manganeso heptahidratado MnSO4•7H2O
El MnSO4 anhidro (sin agua en su estructura) es un sólido blanco cristalino. Sin embargo, las variedades hidratadas son sólidos de color rosado o rojo pálido.

MnSO4 = 151 g/mol
MnSO4•H2O = 169,02 g/mol
Anhidro MnSO4 = 700 ºC
Monohidrato MnSO4•H2O = 400-450 °C
Tetrahidrato MnSO4•4H2O = 30 °C
Anhidro MnSO4 = se descompone a 850 ºC.
Tetrahidrato MnSO4•4H2O = 850 °C
MnSO4 = 3,25 g/cm3
MnSO4•H2O = 2,95 g/cm3
Muy soluble en agua: 52 g/100 mL de agua a 5 °C. Soluble en alcohol. Insoluble en éter. Ligeramente soluble en metanol.
Una solución de MnSO4•H2O al 5% tiene un pH de 3,7.
Al disolverse en agua, el MnSO4 se separa en sus iones Mn2+ y SO42-.
El ion manganeso (ii) Mn2+ en solución ácida o neutra se encuentra unido a 6 moléculas de agua H2O formando el ion hexaacuomanganeso [Mn(H2O)6]2+, el cual es de color rosado.
El ion hexaacuomanganeso [Mn(H2O)6]2+ es bastante resistente a la oxidación. En medio básico (pH alcalino) dicho ion se convierte en el hidróxido de manganeso (ii) Mn(OH)2, el cual sí se oxida fácilmente, formando compuestos de manganeso (III) y manganeso (IV).

Estos son el monohidrato MnSO4•H2O, tetrahidrato MnSO4•4H2O, pentahidrato MnSO4•5H2O y heptahidrato MnSO4•7H2O. Estas formas hidratadas contienen el ion hexaacuomanganeso [Mn(H2O)6]2+ en sus cristales y por esta razón son sólidos rosados.
El monohidrato MnSO4•H2O es ligeramente eflorescente, lo que significa que pierde algo de su agua de hidratación lentamente cuando se expone al ambiente.
El MnSO4 se puede obtener tratando óxido de manganeso (II) MnO, hidróxido manganoso Mn(OH)2 o carbonato de manganeso (II) MnCO3 con ácido sulfúrico H2SO4.
MnCO3 + H2SO4 → MnSO4 + H2O + CO2
El sulfato de manganeso en cantidades ínfimas sirve para ciertas funciones del cuerpo humano y de animales.
Es por ello que tiene importancia como compuesto útil en nutrición y se suministra como un suplemento alimenticio. Se utiliza en trazas (cantidades extremadamente pequeñas).
Cantidades altas pueden ser muy tóxicas y perjudiciales.
El MnSO4 se administra a las aves de corral (gallinas, pavos, patos y faisanes) para prevenir la deficiencia o falta del elemento manganeso en dichos animales.
La falta de manganeso se manifiesta en ellos por ejemplo como la enfermedad llamada perosis, que es la deformación de los huesos de las patas de aves jóvenes.

Se aplica a la alimentación de estas aves en muy pequeñas cantidades o trazas.
El sulfato de manganeso se utiliza como micronutriente en fertilizantes para vides (plantas de uva) y plantaciones de tabaco en suelos deficientes en manganeso.
Sin embargo, algunos estudios indican que el exceso de sulfato de manganeso puede inhibir o disminuir la formación de ciertas enzimas importantes para el crecimiento de las plantas y sus brotes.

Por ejemplo, se ha encontrado que es tóxico para algunos cultivos como el algodón.
El MnSO4 también tiene uso en fungicidas y junto con ciertos compuestos orgánicos forma parte de ciertos pesticidas.
El MnSO4 hidratado se usa por su coloración para preparar pigmentos inorgánicos que se utilizan en barnices rojos para cerámica, en tintes para imprimir en telas y otros materiales.
El sulfato de manganeso se emplea en la manufactura de vidrio y con él también se preparan jabones.

El MnSO4 es el material de partida para obtener el metal manganeso (Mn) de forma electrolítica, esto es, mediante aplicación de electricidad a soluciones acuosas.
También permite obtener dióxido de manganeso MnO2 y carbonato de manganeso MnCO3.
El MnSO4 además se emplea para análisis químicos y en la formulación de soluciones que se utilizan en experimentos de genética con microorganismos.
El sulfato de manganeso contiene el ion manganeso (II) (Mn2+), el cual puede ser tanto inocuo como tóxico dependiendo de las cantidades a las que la persona, animal o planta se expone.
El manganeso es esencial para el funcionamiento normal del organismo de humanos, animales y algunas plantas. Pero desafortunadamente el manganeso también es neurotóxico, es decir, afecta el sistema nervioso y algunas funciones vegetales.
El MnSO4 administrado con los alimentos en forma de trazas (cantidades extremadamente pequeñas o ínfimas) es considerado generalmente seguro por la Administración de Alimentos y Medicamentos, o FDA (siglas del inglés Food and Drug Administration).
La exposición prolongada o repetida a este compuesto en cantidades apreciables puede causar daño al ser humano y animales.
Produce irritación en los ojos y membranas mucosas del tracto respiratorio, anorexia, dolor de cabeza, pérdida del equilibrio, neumonía e infecciones respiratorias.
La inhalación crónica causa daños al sistema nervioso, generando el manganismo, temblor en las manos y síntomas típicos de la enfermedad de Parkinson.
Por lo tanto, se debe evitar la dispersión del polvo de MnSO4, usar equipo de respiración y guantes protectores.
Es tóxico para la vida acuática y en esta genera efectos a largo plazo. Se debe almacenar en lugares donde no haya acceso al sistema de drenaje o cloacas. Es muy importante no permitir que se deseche en el ambiente.
- U.S. National Library of Medicine. (2019). Manganese sulfate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Ullmann’s Encyclopedia of Industrial Chemistry. (1990). Fifth Edition. Volume A22. VCH Verlagsgesellschaft mbH.
- U.S. National Library of Medicine. (2019). Manganese sulfate monohydrate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Dunham, M.J. (2010). Guide to Yeast Genetics: Functional Genomics, Proteomics, and Other Systems Analysis. Medium formulation. In Methods in Enzymology. Recuperado de sciencedirect.com.
- Saric, M. and Lucchini, R. (2007). Manganese. Uses. In Handbook on the Toxicology of Metals (Third Edition). Recuperado de sciencedirect.com.
- Vallero, D. (2014). Neurological Effects of Air Pollutants. Manganese. In Fundamentals of Air Pollution (Fifth Edition). Recuperado de sciencedirect.com.
- Chée, R. (1986). In vitro culture of Vitis: the effects of light spectrum manganese sulfate and potassium iodide on morphogenesis. Plant Cell, Tiss and Organ Cult 7: 121-134 (1986). Recuperado de link.springer.com.
