Ley de la conservación de la materia: experimentos y ejemplos
La ley de la conservación de la materia o masa es aquella que establece que en toda reacción química, la materia no se crea ni se destruye. Esta se ley se basa en el hecho de que los átomos son partículas indivisibles en este tipo de reacciones; mientras que en las reacciones nucleares los átomos se fragmentan, razón por la que no se consideran reacciones químicas.
Si los átomos no se destruyen, entonces cuando un elemento o compuesto reacciona debe mantenerse constante el número de átomos antes y después de la reacción; lo cual se traduce en una cantidad de masa constante entre los reactivos y productos involucrados.
Esto siempre es así si no existe una fuga que ocasione pérdidas de materia; pero si el reactor está cerrado herméticamente, no “desaparece” ningún átomo, y por tanto la masa cargada debe ser igual a la masa después de la reacción.
Si el producto es sólido, por otro lado, su masa será igual a la suma de los reactivos involucrados para su formación. De igual modo ocurre con los productos líquidos o gaseosos, pero es más propenso a cometerse errores al momento de medir sus masas resultantes.
Esta ley nació de experimentos de siglos pasados, fortaleciéndose ante los aportes de varios químicos célebres, como Antoine Lavoisier.
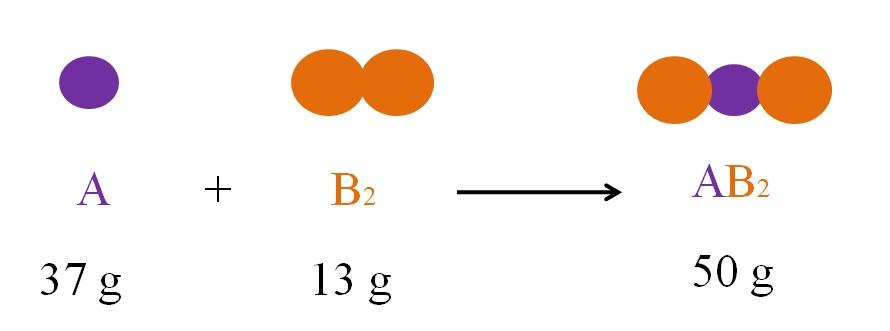
Considere la reacción entre A y B2 para formar AB2 (imagen superior). De acuerdo a la ley de la conservación de la materia, la masa de AB2 debe ser igual a la sumatoria de las masas de A y B2, respectivamente. Entonces, si 37g de A reaccionan con 13g de B2, el producto AB2 debe pesar 50g.
Por lo tanto, en una ecuación química, la masa de los reactivos (A y B2) debe ser siempre igual a la masa de los productos (AB2).
Un ejemplo muy similar al recién descrito es el de la formación de óxidos metálicos, como el orín o herrumbre. La herrumbre es más pesada que el hierro (aunque no lo parezca) ya que el metal reaccionó con una masa de oxígeno para generar el óxido.
Índice del artículo
- 1 ¿En qué consiste la ley de la conservación de la materia o masa?
- 2 ¿Cómo se aplica esta ley en una ecuación química?
- 3 Experimentos que demuestran la ley
- 4 Ejemplos (ejercicios prácticos)
- 5 Referencias
Esta ley señala que una reacción química la masa de los reactantes es igual a la masa de los productos. La ley se expresa en la frase “la materia ni se crea ni se destruye, todo se transforma”, tal como fue enunciada por Julius Von Mayer (1814-1878).
La ley fue elaborada en forma independiente por Mijail Lamanósov, en 1745, y por Antoine Lavoisier en 1785. Si bien los trabajos de investigación de Lamanósov acerca de la Ley de la Conservación de la Masa anteceden a los de Lavoisier, no fueron conocidos en Europa por estar escritos en ruso.
Los experimentos realizados en 1676 por Robert Boyle los llevó a señalar que al incinerarse un material en un recipiente abierto, el material incrementaba su peso; quizás debido a una transformación experimentada por el propio material.
Los experimentos de Lavoiser acerca de la incineración de materiales en recipientes con un ingreso limitado de aire, mostraban una ganancia de peso. Este resultado estaba en concordancia con el obtenido por Boyle.
No obstante, la conclusión de Lavoisier fue distinta. Pensó que durante la incineración una cantidad de masa era extraída del aire, lo que explicaría el aumento de masa que se observaba en los materiales sometidos a la incineración.
Lavoiser pensaba que la masa de los metales permanecía constante durante la incineración, y que la disminución de la incineración en los recipientes cerrados no era causada por una disminución en un flojisto (concepto en desuso), una supuesta esencia relacionada con la producción del calor.
Lavoiser señaló que la disminución observada era causada, más bien, por una disminución en la concentración de los gases en los recipientes cerrados.
La ley de conservación de la masa es de una importancia trascendental en estequiometria, definiéndose esta última como el cálculo de las relaciones cuantitativas entre los reactivos y los productos presentes en una reacción química.
Los principios de la estequiometria fueron enunciados en 1792 por Jeremías Benjamín Richter (1762-1807), quien la definió como la ciencia que mide las proporciones cuantitativas o relaciones de masa de los elementos químicos que están involucrados en una reacción.
En una reacción química hay una modificación de las sustancias que intervienen en ella. Se observa que los reactivos o reactantes se consumen para originar los productos.
Durante la reacción química hay rupturas de enlaces entre los átomos, así como la formación de nuevos enlaces; pero el número de átomos que intervienen en la reacción permanece inalterado. Esto es lo que se conoce como la ley de conservación de la materia.
Esta Ley implica dos principios básicos:
-El número total de átomos de cada tipo es igual en los reactivos (antes de la reacción) y en los productos (después de la reacción).
-La suma total de las cargas eléctricas antes y después de la reacción permanece constante.
Esto es debido a que el número de las partículas subatómicas permanece constante. Estas partículas son los neutrones sin carga eléctrica, los protones con carga positiva (+), y los electrones con carga negativa (-). Por lo que no cambia la carga eléctrica durante una reacción.
Habiendo dicho lo anterior, al momento de representar una reacción química mediante una ecuación (como la de la imagen principal), debe respetarse los principios básicos. La ecuación química usa símbolos o representaciones de los diferentes elementos o átomos, y cómo se encuentran agrupados en moléculas antes o después de la reacción.
Se utilizará nuevamente la siguiente ecuación como ejemplo:
A + B2 => AB2
El subíndice es un número que se coloca en la parte derecha de los elementos (B2 y AB2) en su parte inferior, indicando el número de átomos de un elemento presentes en una molécula. Este número no puede ser cambiado sin la producción de una molécula nueva, distinta a la original.
El coeficiente estequiométrico (1, en el caso de A y el resto de las especies) es un número que se coloca en parte izquierda de los átomos o moléculas, indicativo del número de ellos que intervienen en una reacción.
En una ecuación química, si la reacción es irreversible se coloca una sola flecha, que indica el sentido de la reacción. Si la reacción es reversible, hay dos flechas en sentido opuesto. A la izquierda de las flechas se ubican los reactivos o reactantes (A y B2), mientras que a la derecha se encuentran los productos (AB2).
Balanceo
Balancear una ecuación química es un procedimiento que permite igualar el número de átomos de los elementos químicos presentes en los reactivos con los de los productos.
Dicho en otros términos, la cantidad de átomos de cada elemento tiene que ser igual en el lado de los reactivos (antes de la flecha) y en el lado de productos de la reacción (después de la flecha).
Se dice que cuando una reacción está balanceada, se está respetando la Ley de Acción de Masa.
Por lo tanto, es indispensable balancear el número de átomos y las cargas eléctricas en ambos lados de la flecha en una ecuación química. Asimismo, la suma de las masas de los reactivos, debe ser igual a la suma de las masas de los productos.
Para el caso de la ecuación representada, ya está balanceada (igual número de A y B en ambos lados de la flecha).
Lavoiser, observando la incineración de metales como el plomo y el estaño en envases cerrados con un ingreso limitado de aire, reparó en que los metales se encontraban recubiertos de un calcinado; y además, que el peso del metal en un momento determinado del calentamiento era igual al inicial.
Como al incinerar un metal se observa un aumento de peso, Lavoiser pensó que el exceso de peso observado podría ser explicado por una cierta masa de algo que se extrae del aire durante la incineración. Por esta razón la masa permanecía constante.
Esta conclusión, que podría ser considerada con una base científica poco sólida, no es tal, habida cuenta del conocimiento que tenía Lavoiser acerca de la existencia del oxígeno para el momento en que enunció su Ley (1785).
El oxígeno fue descubierto por Carl Willhelm Scheele en 1772. Posteriormente, Joseph Priesley lo descubrió de forma independiente, y publicó los resultados de su investigación, tres años antes de que Scheele publicara sus resultados acerca de este mismo gas.
Priesley calentó monóxido de mercurio y recogió un gas que producía un aumento de la brillantez de la llama. Además, al introducir los ratones en un envase con el gas se tornaban más activos. Priesley llamó a este gas desflogistizado.
Priesley comunicó sus observaciones a Antoine Lavoiser (1775), quien repitió sus experimentos demostrando que el gas se encontraba en el aire y en el agua. Lavoiser reconoció al gas como un nuevo elemento, dándole el nombre de oxígeno.
Cuando Lavoisier utilizó como argumento para enunciar su ley, que el exceso de masa observado en la incineración de los metales era debido a algo que se extrajo del aire, pensaba en el oxígeno, elemento que se combina con los metales durante incinaración.
Si se calientan 232,6 de monóxido de mercurio (HgO), se descompone en mercurio (Hg) y oxígeno molecular (O2). Basándose en la ley de conservación de la masa y en los pesos atómicos: (Hg = 206,6 g/mol) y (O = 16 g/mol), señale la masa de Hg y O2 que se forma.
HgO => Hg + O2
232,6 g 206,6 g 32 g
Los cálculos son muy directos, ya que se está descomponiendo exactamente un mol de HgO.

Una cinta de magnesio de 1,2 g se incineró en un recipiente cerrado que contenía 4 g de oxígeno. Después de la reacción quedaron 3,2 g de oxígeno sin reaccionar. ¿Cuánto de óxido de magnesio se formó?
Lo primero que hay que calcular es la masa de oxígeno que reaccionó. Esto se puede calcular fácilmente, mediante una sustracción:
Masa de O2 que reaccionó = masa inicial de O2 – masa final de O2
(4 – 3,2) g O2
0,8 g de O2
Basándose en la ley de la conservación de la masa, se puede calcular la masa de MgO formada.
Masa de MgO = masa de Mg + masa de O
1,2 g+0,8 g
2,0 g MgO
Una masa de 14 g de óxido de calcio (CaO) reaccionó con 3,6 g de agua (H2O), que se consumió totalmente en la reacción para formar 14,8 g de hidróxido de calcio, Ca(OH)2:
¿Qué cantidad de óxido de calcio reaccionó para formar hidróxido de calcio?
¿Qué cantidad de óxido de calcio sobró?
La reacción puede ser esquematizada mediante la ecuación siguiente:
CaO + H2O => Ca(OH)2
La ecuación está balanceada. Por lo tanto cumple con la ley de conservación de la masa.
Masa de CaO que interviene en la reacción = masa de Ca(OH)2 – masa de H2O
14,8 g – 3,6 g
11,2 g CaO
Por lo tanto, el CaO que no reaccionó (el que sobra) se calcula haciendo una resta:
Masa de CaO sobrante = masa presente en la reacción – masa que intervino en la reacción.
14 g de CaO – 11,2 g de CaO
2,8 g CaO
¿Qué cantidad de óxido de cobre (CuO) se formará cuando reaccionen completamente 11 g de cobre (Cu) con el oxígeno (O2)? ¿Qué cantidad de oxígeno se necesitan en la reacción?
El primer paso es balancear la ecuación. La ecuación balanceada queda de la forma siguiente:
2Cu + O2 => 2CuO
La ecuación está balanceada, por lo que cumple con la ley de la conservación de la masa.
El peso atómico del Cu es 63,5 g/mol, y el peso molecular de CuO es 79,5 g/mol.
Hay que determinar cuánto CuO se forma a partir de la oxidación completa de los 11 g de Cu:
Masa CuO = (11 g de Cu) ∙ (1mol de Cu/63,5 g Cu) ∙ (2 mol CuO/2mol Cu) ∙ (79,5 g CuO/ mol CuO)
Masa de CuO formado = 13,77 g
Por lo tanto, la diferencia de las masas entre el CuO y el Cu da la cantidad de oxígeno que interviene en la reacción:
Masa del oxígeno = 13,77 g – 11 g
1,77 g O2
Una masa de cloro (Cl2) de 2,47 g se hizo reaccionar con suficiente sodio (Na) y se formaron 3,82 g de cloruro de sodio (NaCl). ¿Qué cantidad de Na reaccionó?
Ecuación balanceada:
2Na + Cl2 => 2NaCl
Según la ley de la conservación de la masa:
Masa del Na = masa del NaCl – masa Cl2
3,82 g – 2,47 g
1,35 g Na
- Flores, J. Química (2002). Editorial Santillana.
- Wikipedia. (2018). Ley de conservación de la materia. Recuperado de: es.wikipedia.org
- Instituto Politécnico Nacional. (s.f.). Ley de la conservación de la masa. CGFIE. Recuperado de: aev.cgfie.ipn.mx
- Helmenstine, Anne Marie, Ph.D. (18 de enero de 2019). Law of Conservation of Mass. Recuperado de: thoughtco.com
- Shrestha B. (18 de noviembre de 2018). The law of conservation of matter. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
