Glutamato (neurotransmisor): definición y funciones
El glutamato media la mayor parte de sinapsis excitatorias del Sistema Nervioso Central (SNC). Es el principal mediador de la información sensorial, motora, cognitiva, emocional e interviene en la formación de memorias y en su recuperación, estando presente en el 80-90% de sinapsis del cerebro.
Por si es poco mérito todo esto, también interviene en la neuroplasticidad, los procesos de aprendizaje y es el precursor del GABA –el principal neurotransmisor inhibitorio del SNC–. ¿Qué más se le puede pedir a una molécula?
¿Qué es el glutamato?
Posiblemente ha sido uno de los neurotransmisores más exhaustivamente estudiados del sistema nervioso. En los últimos años su estudio ha ido en aumento debido a su relación con diversas patologías neurodegenerativas (como por ejemplo la enfermedad de Alzheimer), lo que le ha convertido en una potente diana farmacológica en diversas enfermedades.
También cabe mencionar que dada la complejidad de sus receptores, éste es uno de los neurotransmisores más complicados de estudiar.
El proceso de síntesis
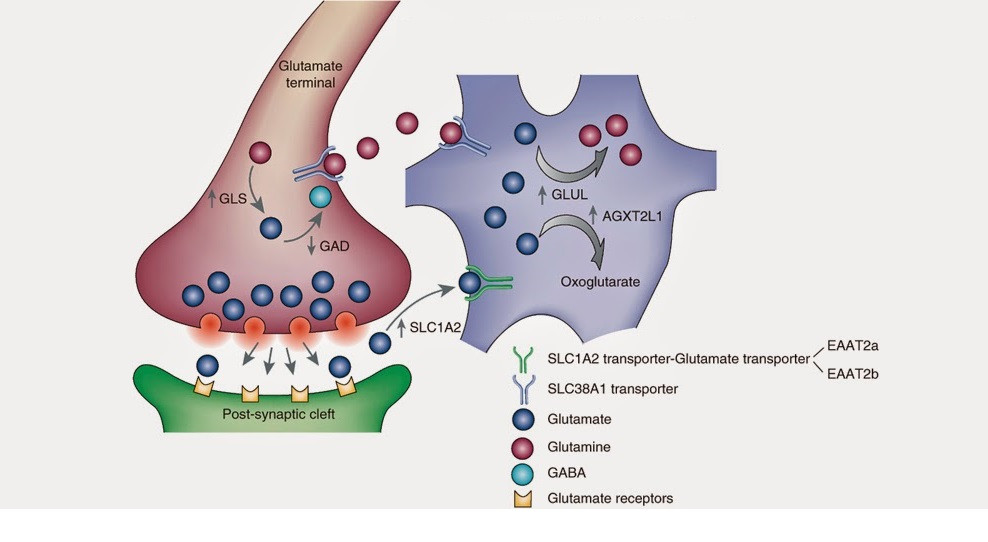
El proceso de síntesis del glutamato tiene su inicio en el ciclo de Krebs, o ciclo de los ácidos tricarboxílicos. El ciclo de Krebs es una ruta metabólica o, para que nos entendamos, una sucesión de reacciones químicas con el fin de producir la respiración celular en la mitocondria. Un ciclo metabólico puede entenderse como el mecanismo de un reloj, en el que cada engranaje cumple una función y el simple fallo de una pieza puede ocasionar que el reloj se estropee o no marque bien la hora. Los ciclos en bioquímica son los mismo. Una molécula, por medio de continuas reacciones enzimáticas –los engranajes del reloj–, va cambiando su forma y composición con el objetivo de dar lugar a una función celular. El principal precursor del glutamato será el alfa-cetoglutarato, que recibirá un grupo amino por transaminación para convertirse en glutamato.
También cabe comentar otro precursor bastante significativo: la glutamina. Cuando la célula libera el glutamato al espacio extracelular, los astrocitos –un tipo de célula glial– recuperan este glutamato que, mediante una encima llamada glutamina sintetasa, pasará a ser glutamina. Luego, los astrocitos liberan la glutamina, que es recuperada de nuevo por las neuronas para ser transformada de nuevo en glutamato. Y posiblemente más de uno se preguntará lo siguiente: Y si han de volver de nuevo la glutamina a glutamato en la neurona, ¿por qué al astrocito le da por convertir en glutamina al pobre glutamato? Pues yo tampoco lo sé. Quizá es que no se ponen de acuerdo los astrocitos y las neuronas o quizá es que la Neurociencia es así de complicada. En cualquiera de los casos, he querido hacer una reseña a los astrocitos porque su colaboración supone el 40% del turnover del glutamato, lo cual quiere decir que la mayor parte del glutamato es recuperado por estas células gliales.
Hay otros precursores y otras vías por las que se recupera el glutamato que se libera al espacio extracelular. Por ejemplo hay neuronas que contienen un transportador específico del glutamato –EAAT1/2– que recuperan directamente el glutamato a la neurona y permiten finalizar la señal excitatoria. Para mayor estudio de la síntesis y metabolismo del glutamato recomiendo la lectura de la bibliografía.
Los receptores del glutamato
Como nos suelen enseñar, cada neurotransmitor tiene sus receptores en la célula postsináptica. Los receptores, ubicados en la membrana celular, son proteínas a las que se une un neurotransmisor, hormona, neuropéptido, etc., para dar lugar a una serie de cambios en el metabolismo celular de la célula en el que está ubicado en el receptor. En las neuronas generalmente ubicamos los receptores en las células postsinápticas, aunque no tiene porque ser así en realidad.
También nos suelen enseñar en primero de carrera que existen dos tipos de receptores principales: los ionotrópicos y los metabotrópicos. Los ionotrópicos son aquellos en los que cuando se une su ligando –la “llave” del receptor– abren canales que permiten el paso de iones al interior de la célula. Los metabotrópicos, en cambio, cuando se une el ligando ocasionan cambios en la célula por medio de segundos mensajeros. En esta revisión hablaré de los principales tipos de receptores ionotrópicos del Glutamato, aunque recomiendo el estudio de la bibliografia para el conocimiento de los receptores metabotrópicos. A continuación cito los principales receptores ionotrópicos:
- Receptor de NMDA.
- Receptor de AMPA.
- Receptor de Kainado.
Los receptores de NMDA y AMPA y su estrecha relación
Se cree que ambos tipos de receptores son macromoléculas formadas por cuatro dominios transmembrana –es decir, estan formados por cuatro subunidades que atraviesan la bicapa lipídica de la membrana celular– y ambos son receptores de glutamato que abrirán canales de cationes –iones cargados positivamente–. Pero, aun así, son significativamente diferentes.
Una de sus diferencias es el umbral en el que se activan. En primer lugar, los receptores de AMPA son mucho más rápidos en activarse; mientras que los receptores de NMDA no se podrán activar hasta que la neurona tenga un potencial de membrana de unos -50mV –una neurona cuando está inactivada suele estar a unos -70mV–. En segundo lugar, el paso cationes será diferente en cada caso. Los receptores de AMPA lograran potenciales de membrana mucho más altos que los receptores de NMDA, los cuales colabaran de forma mucho más modesta. A cambio, los receptores de NMDA lograrán activaciones mucho más sostenidas en tiempo que los de AMPA. Por tanto, los de AMPA se activan rápido y producen potenciales excitatorios más fuertes, pero se desactivan rápido. Y los de NMDA tardan en activarse, pero logran mantener mucho más tiempo los potenciales excitatorios que generan.
Para entenderlo mejor, imaginemos que somos soldados y que nuestras armas representan los diferentes receptores. Imaginemos que el espacio extracelular es una trinchera. Tenemos dos tipos de armas: revólver y granadas. Las granadas son sencillas y rápidas de usar: quitas la anilla, la tiras y esperas a que explota. Tienen mucho potencial destructor, pero una vez que las hemos tirado todas, se ha acabado. El revólver es una arma que se tarda lo suyo en cargar porque hay que quitar el tambor y poner las balas una a una. Pero una vez lo hemos cargado tenemos seis disparos con los que podemos sobrevivir un rato, aunque con mucho menos potencial que una granada. Nuestros revólveres cerebrales son los receptores de NMDA y nuestras granadas los de AMPA.
Los excesos de glutamato y sus peligros
Dicen que en exceso nada es bueno y en el caso del glutamato se cumple. A continuación citaremos algunas patologías y problemas neurológicos en los que se encuentra relacionado un exceso de glutamato.
1. Los análogos del glutamato pueden causar exotoxicidad
Las drogas análogas al glutamato –es decir, que cumplen la misma función que éste– como el NMDA –al cual el receptor de NMDA debe su nombre– pueden provocar a altas dosis efectos neurodegenerativos en las regiones cerebrales más vulnerables tales como el núcleo arcuato del hipotálamo. Los mecanismo involucrados en esta neurodegeneración son diversos e implican diferentes tipos de receptores del glutamato.
2. Algunas neurotoxinas que podemos ingerir en nuestra dieta ejercen muerte neuronal por medio del exceso de glutamato
Diferentes venenos de algunos animales y plantas ejercen sus efectos por medio de las vías nerviosas del glutamato. Un ejemplo es el veneno de las semillas de Cycas Circinalis, una planta venenosa que podemos encontrar en la isla del pacífico de Guam. Este veneno ocasionó una gran prevalencia de Esclerosis Lateral Amiotrófica en esta isla en que sus habitantes la ingerían a diario creyendo que era benigna.
3. El glutamato contribuye a la muerte neuronal por isquemia
El glutamato es el neurotransmisor principal en los trastornos cerebrales agudos como el infarto, parada cardíaca, hipoxia pre/perinatal. En estos eventos en los que hay una falta de oxígeno en el tejido cerebral, las neuronas se mantienen en un estado de despolarización permanente; por causa de diferentes procesos bioquímicos. Eso conlleva la liberación permanente de glutamato de las células, con la subsiguiente activación sostenida de los receptores de glutamato. El receptor de NMDA es especialmente permeable al calcio en comparación a otros receptores ionotrópicos, y el calcio en exceso conlleva la muerte neuronal. Por tanto, la hiperactividad de los receptores glutamatérgicos conlleva la muerte neuronal debido al aumento de calcio intraneuronal.
4. Epilepsia
La relación entre el glutamato y la epilepsia está bien documentada. Se considera que la actividad epiléptica se relaciona especialmente con los receptores de AMPA, aunque a medida que la epilepsia progresa los receptores de NMDA adquieren importancia.
¿El glutamato es bueno? ¿El glutamato es malo?
Habitualmente, cuando uno lee este tipo de textos acaba humanizando las moléculas poniéndole etiquetas de “buena” o “mala” –eso tiene un nombre y se llama antropomorfismo, muy de moda allá en la época medieval–. La realidad dista bastante de estos juicios tan simplistas.
En una sociedad en la que hemos generado un concepto de “salud” es fácil que algunos de los mecanismos de la naturaleza nos incomoden. El problema es que la naturaleza no entiende de “salud”. Eso lo hemos creado nosotros mediante la medicina, industrias farmacéuticas y psicología. Es un concepto social, y como todo concepto social está supeditado al avance de la sociedades, sea humano o científico. Los avances demuestran que el glutamato se relaciona con un buen número de patologías como el Alzheimer o la Esquizofrenia. Esto no es un mal de ojo de la evolución al ser humano, más bien es una desadaptación bioquímica de un concepto que la naturaleza todavía no entiende: la sociedad humana en el siglo XXI.
Y como siempre, ¿por qué estudiar esto? En este caso creo que la respuesta está muy clara. Debido al rol que tiene el glutamato en diversas patologías neurodegenerativas resulta en una importante –aunque también compleja– diana farmacológica. Algunos ejemplos de estas enfermedades, aunque no hayamos hablado de ellas en esta revisión porque considero que se podría escribir una entrada exclusívamente sobre ésto, son la enfermedad de Alzheimer y la Esquizofrenia. Subjetivamente, encuentro especialmente interesante la búsqueda de nuevos fármacos para la esquizofrenia por dos razones básicamente: la prevalencia de esta enfermedad y el coste sanitario que conlleva; y los efectos adversos de los actuales antipsicóticos que en muchos casos obstaculizan la adherencia terapéutica.
Texto corregido y editado por Frederic Muniente Peix
Referencias bibliográficas:
Libros:
- Siegel, G. (2006). Basic neurochemistry. Amsterdam: Elsevier.
Artículos:
- Citri, A. & Malenka, R. (2007). Synaptic Plasticity: Multiple Forms, Functions, and Mechanisms.Neuropsychopharmacology, 33(1), 18-41. http://dx.doi.org/10.1038/sj.npp.1301559
- Hardingham, G. & Bading, H. (2010). Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders. Nature Reviews Neuroscience, 11(10), 682-696. http://dx.doi.org/10.1038/nrn2911
- Hardingham, G. & Bading, H. (2010). Synaptic versus extrasynaptic NMDA receptor signalling: implications for neurodegenerative disorders. Nature Reviews Neuroscience, 11(10), 682-696. http://dx.doi.org/10.1038/nrn2911
- Kerchner, G. & Nicoll, R. (2008). Silent synapses and the emergence of a postsynaptic mechanism for LTP. Nature Reviews Neuroscience, 9(11), 813-825. http://dx.doi.org/10.1038/nrn2501
- Papouin, T. & Oliet, S. (2014). Organization, control and function of extrasynaptic NMDA receptors.Philosophical Transactions Of The Royal Society B: Biological Sciences, 369(1654), 20130601-20130601. http://dx.doi.org/10.1098/rstb.2013.0601
