Te explicamos
Cómo se forman los ácidos, bases y sales
Existen varias teorías para definir los ácidos y las bases, entre las que se encuentran la de Arrhenius, la de Brönsted-Lowry y la de Lewis.
![]()
![]() Según la teoría de Arrhenius. Un ácido es una sustancia que cuando está en disolución acuosa cede iones hidronio (H3O+) o (H+), mientras que una base es una sustancia que en disolución acuosa cede iones hidroxilo (OH–). Por ejemplo: el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH) son un ácido y una base de Arrhenius respectivamente.
Según la teoría de Arrhenius. Un ácido es una sustancia que cuando está en disolución acuosa cede iones hidronio (H3O+) o (H+), mientras que una base es una sustancia que en disolución acuosa cede iones hidroxilo (OH–). Por ejemplo: el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH) son un ácido y una base de Arrhenius respectivamente.

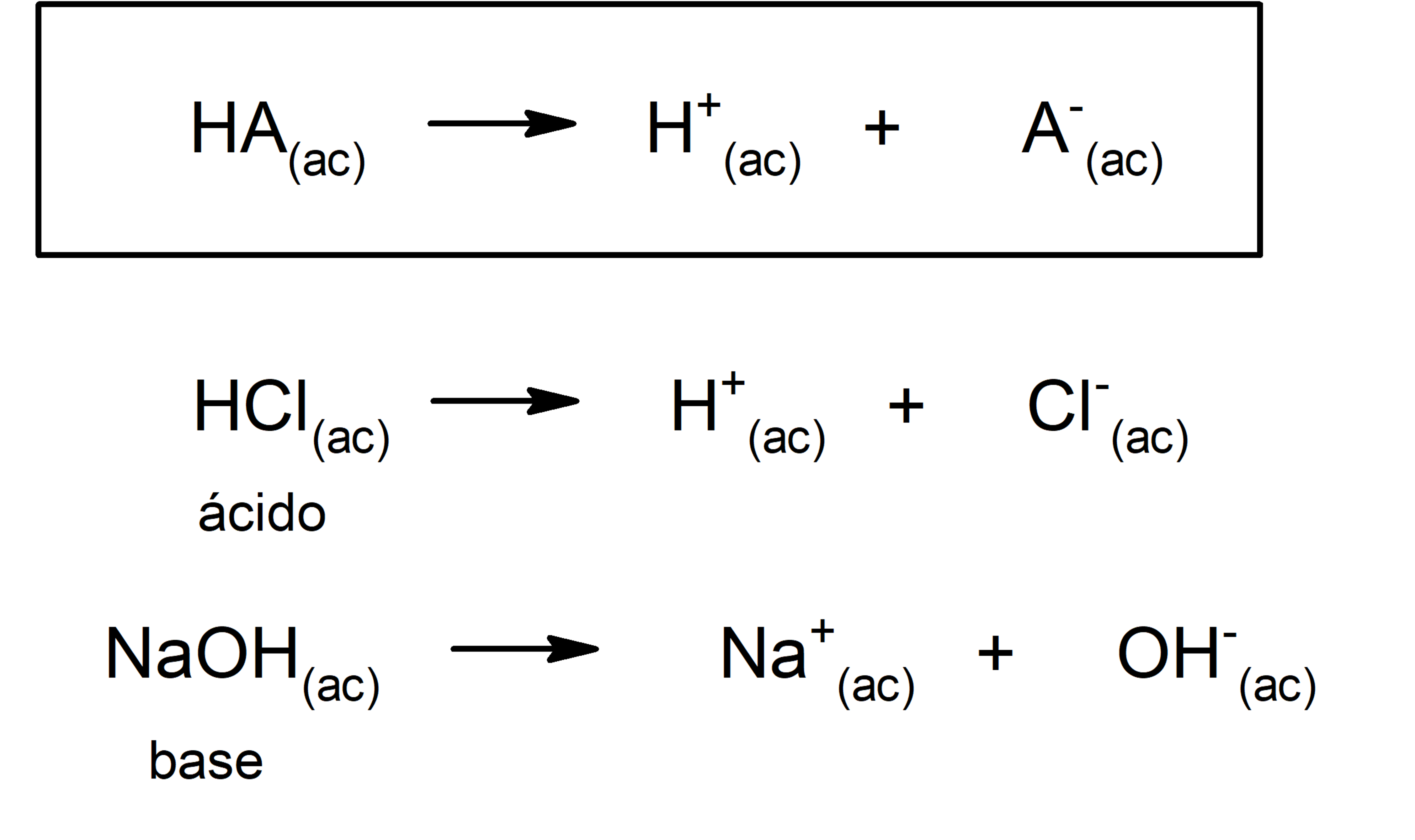
![]()
![]() Según la teoría de Brönsted-Lowry. Un ácido es una especie química que cede un ion hidronio a otra especie química (base de Brönsted-Lowry), mientras que una base es una especie química que acepta un ion hidronio de otra especie química (ácido de Brönsted-Lowry). Por ejemplo: el ácido acético (CH3COOH) y el amoníaco (NH3) son un ácido y una base de Brönsted-Lowry respectivamente.
Según la teoría de Brönsted-Lowry. Un ácido es una especie química que cede un ion hidronio a otra especie química (base de Brönsted-Lowry), mientras que una base es una especie química que acepta un ion hidronio de otra especie química (ácido de Brönsted-Lowry). Por ejemplo: el ácido acético (CH3COOH) y el amoníaco (NH3) son un ácido y una base de Brönsted-Lowry respectivamente.

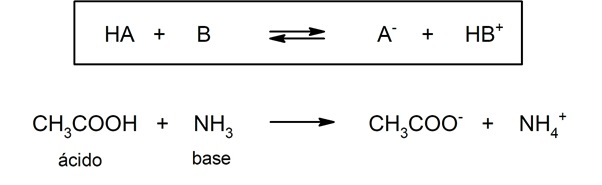
![]()
![]() Según la teoría de Lewis. Un ácido es una sustancia química que acepta un par de electrones de otra sustancia química (base de Lewis), mientras que una base de Lewis es una sustancia que cede un par de electrones a otra sustancia (ácido de Lewis). Por ejemplo: el trifluoruro de boro (BF3) y el ion fluoruro (F–) son un ácido y una base de Lewis respectivamente.
Según la teoría de Lewis. Un ácido es una sustancia química que acepta un par de electrones de otra sustancia química (base de Lewis), mientras que una base de Lewis es una sustancia que cede un par de electrones a otra sustancia (ácido de Lewis). Por ejemplo: el trifluoruro de boro (BF3) y el ion fluoruro (F–) son un ácido y una base de Lewis respectivamente.

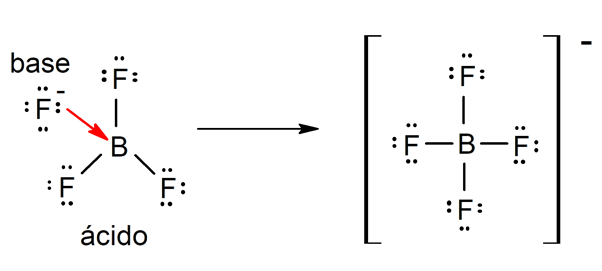
Los ácidos de tipo oxácidos suelen formarse por la reacción entre un óxido no metálico con el agua, mientras que los ácidos de tipo hidrácidos se forman por la combinación de un no metal con el hidrógeno en solución acuosa. Por ejemplo: el ácido sulfúrico (H2SO4) es un oxácido y el ácido clorhídrico (HCl(ac)) es un hidrácido.

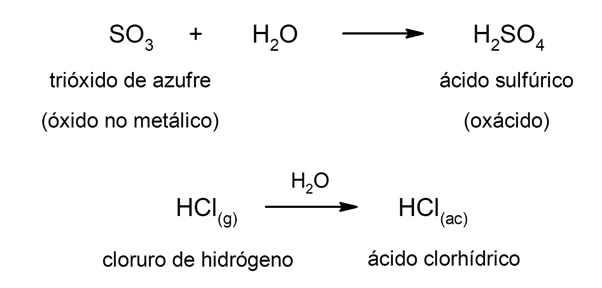
Por otra parte, las bases pueden formarse como resultado de la reacción entre un óxido metálico y el agua. Por ejemplo: el hidróxido de magnesio (Mg(OH)2).

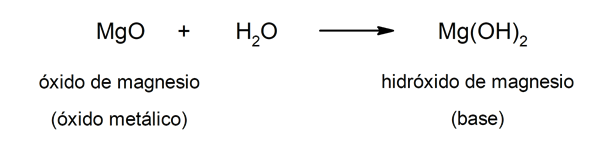
![]()
![]() Puede servirte: Sustancias neutras
Puede servirte: Sustancias neutras
Características generales de ácidos y bases
En general, los ácidos son agrios y corrosivos. Las bases también son corrosivas, de sabor amargo, cáusticas cuando entran en contacto con la piel y tienen un tacto jabonoso. Por otro lado, las disoluciones de ácidos tienen un pH menor que 7, mientras que las disoluciones de bases tienen un pH mayor que 7.
Fortaleza de ácidos y bases
La tendencia de un ácido a disociarse y disminuir el pH a menudo se califica como “fortaleza de dicho ácido”. Un ácido es fuerte cuando se puede disociar completamente en disolución acuosa y es débil cuando su disociación ocurre parcialmente. Son ejemplos de ácidos fuertes el perclórico (HClO4), sulfúrico (H2SO4), yodhídrico (HI), bromhídrico (HBr), clorhídrico (HCl) y nítrico (HNO3). Por otra parte, el ácido acético (CH3COOH), el cítrico (C6H8O7) y el benzoico (C6H5COOH) son débiles.

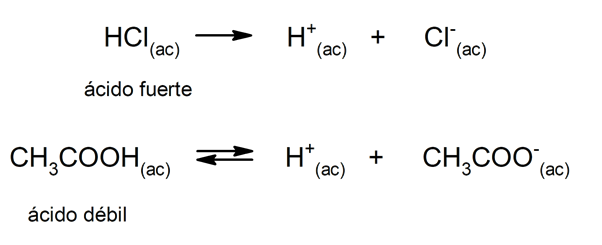
De manera similar, pueden considerarse como bases fuertes a las que se disocian completamente en disolución acuosa, y débiles cuando su disociación ocurre parcialmente. Son ejemplos de bases fuertes el hidróxido de potasio (KOH), de sodio (NaOH), de litio (LiOH) y de magnesio (Mg(OH)2). Por otra parte, el amoníaco (NH3) es una base débil.

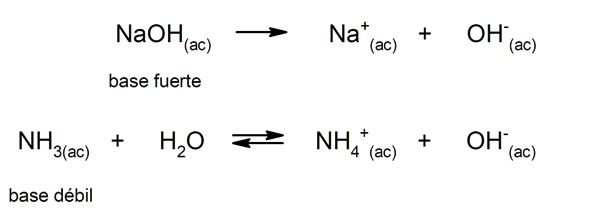
¿Cómo se forman las sales?
Las sales son compuestos iónicos de diversa complejidad, abundantes en la naturaleza y generalmente se forman por la combinación de ácidos con bases en una reacción de neutralización, que genera una liberación de agua. También se pueden formar como resultado de la reacción entre un metal y un ácido, de un metal y un no metal, o de la reacción entre distintas sales.
Las sales se pueden clasificar en:
![]()
![]() Sales neutras o binarias. Están compuestas solamente por un metal y un no metal. Por ejemplo: cloruro de sodio (NaCl) y bromuro de potasio (KBr).
Sales neutras o binarias. Están compuestas solamente por un metal y un no metal. Por ejemplo: cloruro de sodio (NaCl) y bromuro de potasio (KBr).![]()
![]() Sales ácidas. Se forman cuando se sustituyen parcialmente los hidrógenos de un oxácido. Por ejemplo: hidrogenocarbonato de sodio (NaHCO3), se sustituye un hidrógeno del ácido carbónico (H2CO3).
Sales ácidas. Se forman cuando se sustituyen parcialmente los hidrógenos de un oxácido. Por ejemplo: hidrogenocarbonato de sodio (NaHCO3), se sustituye un hidrógeno del ácido carbónico (H2CO3).![]()
![]() Sales oxácidas o ternarias. Se forman cuando se sustituyen todos los hidrógenos de un oxácido. Por ejemplo: sulfato de magnesio (MgSO4), se sustituyen todos los hidrógenos del ácido sulfúrico (H2SO4).
Sales oxácidas o ternarias. Se forman cuando se sustituyen todos los hidrógenos de un oxácido. Por ejemplo: sulfato de magnesio (MgSO4), se sustituyen todos los hidrógenos del ácido sulfúrico (H2SO4).![]()
![]() Sales dobles. Se forman cuando se sustituyen dos hidrógenos de un oxácido por dos cationes distintos. Por ejemplo: sulfato doble de sodio y potasio (KNaSO4), se sustituyen dos hidrógenos del ácido sulfúrico (H2SO4).
Sales dobles. Se forman cuando se sustituyen dos hidrógenos de un oxácido por dos cationes distintos. Por ejemplo: sulfato doble de sodio y potasio (KNaSO4), se sustituyen dos hidrógenos del ácido sulfúrico (H2SO4).![]()
![]() Sales básicas. Están formadas por el ion hidróxido (OH–) y otros aniones. Por ejemplo: cloruro de trihidróxido de cobre (II) (Cu2Cl(OH)3).
Sales básicas. Están formadas por el ion hidróxido (OH–) y otros aniones. Por ejemplo: cloruro de trihidróxido de cobre (II) (Cu2Cl(OH)3).
Distribución e importancia
Los ácidos son importantísimos tanto en la industria como en la naturaleza. Por ejemplo, el ácido clorhídrico forma parte de nuestro sistema digestivo y es necesario para que podamos degradar los compuestos nutritivos presentes en los alimentos. El ácido desoxirribonucleico, más conocido como ADN, compone los cromosomas, que es donde se codifica la información genética necesaria para que los seres vivos se multipliquen y desarrollen. El ácido bórico es un componente destacado en la industria del vidrio.
El carbonato de calcio es una sal muy abundante en diversos tipos de rocas calizas. Por acción de altas temperaturas (900 °C) del carbonato de calcio se obtiene el óxido de calcio o cal viva. La adición de agua a la cal viva produce hidróxido de calcio, llamada cal apagada, que es una base. Estos materiales se utilizan en la construcción.
Sigue con:
 Compartir en Facebook
Compartir en Facebook Twittear
Twittear
 Según la teoría de Arrhenius. Un ácido es una
Según la teoría de Arrhenius. Un ácido es una  Puede servirte:
Puede servirte: