Definición de solvatación
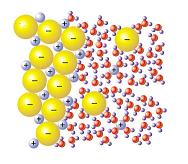 Solvatación no es un término aceptado en el diccionario que elabora la Real Academia Española (RAE). Se trata de un concepto que se suele emplear en el ámbito de la química con referencia al proceso que implica la atracción y la asociación de los iones de un soluto y las moléculas de un disolvente.
Solvatación no es un término aceptado en el diccionario que elabora la Real Academia Española (RAE). Se trata de un concepto que se suele emplear en el ámbito de la química con referencia al proceso que implica la atracción y la asociación de los iones de un soluto y las moléculas de un disolvente.
Para comprender la noción, por lo tanto, primero debemos saber a qué se refieren otros términos. Se llama disolución a la mezcla de tipo homogéneo compuesta por un disolvente (también conocido como solvente) y uno o más solutos. En esta mezcla, los solutos se disuelven en el disolvente: de este modo, hay un nivel más alto de disolvente que de solutos en la disolución.
Cuando los iones del soluto se disuelven, se produce la solvatación. Estos iones se separan entre sí y comienzan a ser rodeados por las moléculas que componen el disolvente. La solvatación del ion está vinculada a su tamaño, ya que de él depende la cantidad de moléculas de disolvente que lo rodean.
Puede decirse que la solvatación se produce a partir de las interacciones de un soluto con un disolvente, que llevan a la estabilización del soluto en la disolución. El proceso requiere que los iones de la red cristalina se liberen: para eso se necesita quebrar la atracción que existe entre los iones debido a la energía reticular. Los iones del soluto, al asociarse con las moléculas del disolvente, liberan una clase de energía que se denomina energía libre de solvatación.
Es importante no confundir los conceptos de solubilidad, disolución y solvatación, aunque puedan tener ciertas semejanzas a simple vista. Mientras la disolución hace referencia al agregado de soluto en un solvente, o bien a aumentar el porcentaje de solvente en una determinada solución de existencia previa, el término solubilidad hace referencia a la cantidad máxima que se puede agregar de soluto al solvente antes de que su formación sea precipitada, o sea, de que se forme un excedente de soluto sin disolver.
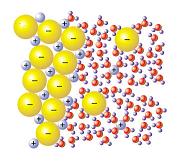 Retomando la solvatación, es posible hablar de estado solvatado para describir la situación en la cual un ion de una determinada solución se encuentra complejado por moléculas del solvente. El término complejado, por su parte, significa formado por un mínimo de dos componentes que se asocian a través de un enlace químico denominado de coordinación, el cual suele ser menos fuerte que un enlace covalente normal.
Retomando la solvatación, es posible hablar de estado solvatado para describir la situación en la cual un ion de una determinada solución se encuentra complejado por moléculas del solvente. El término complejado, por su parte, significa formado por un mínimo de dos componentes que se asocian a través de un enlace químico denominado de coordinación, el cual suele ser menos fuerte que un enlace covalente normal.
Otro concepto que entra en juego en este contexto es el de
Dicho proceso de solvatación de iones desemboca en que el sistema se estabilice. Entre los solventes polares más conocidos, el agua está en el primer puesto, ya que es el que más ha sido estudiado y el más fácil de hallar en la naturaleza; a este grupo también pertenecen el dimetil sulfóxido, el acetonitrilo, el metanol, el amoníaco, la acetona, el etanol y el carbonato de propileno. Los mismos se pueden usar para la disolución de sales, entre otros compuestos inorgánicos.
Hay más de un tipo de interacción molecular que tiene lugar durante la solvatación: ion-dipolo, puente de hidrógeno, fuerzas de London o atracción dipolo-dipolo. Salvo fuerzas de London, el resto solamente se encuentra en solventes polares. Las ion-ion, por su parte, se dan en solventes iónicos (un caso posible es la fase fundida).
