Definición de reacción de síntesis
Antes de entrar de lleno en la definición de reacción de síntesis, se hace necesario que procedamos a conocer el origen etimológico de las dos palabras clave que le dan forma:
-Reacción deriva del latín y es fruto de la suma de dos componentes: el prefijo “re-”, que significa “hacia atrás”, y “actio”. Esta segunda palabra, a su vez, emana del verbo “agere”, que es sinónimo de “hacer”, y del sufijo “-tio”, que se usa para indicar “acción y efecto”.
-Síntesis, por otro lado, tiene su origen en el griego. Y es que procede del sustantivo “synthesis”, que viene a significar “composición que se forma a partir de la suma de las partes”. Ese nombre se obtiene de sumar el prefijo “syn-”, que puede traducirse como “con”, y “thesis”, que es sinónimo de “conclusión”.
Una reacción química es un cambio que experimenta una sustancia. A partir de esta reacción, la sustancia en cuestión pierde propiedades y adquiere otras diferentes, modificando su estructura y sus enlaces químicos.
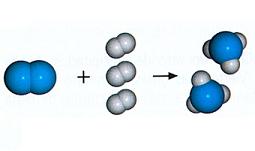 Existen diferentes tipos de reacciones químicas. Una reacción de síntesis es aquella que lleva a que dos sustancias distintas (es decir, dos reactivos) se combinen para dar lugar a un único producto. Puede decirse, por lo tanto, que dos elementos sencillos, a través de una reacción de síntesis, se unen y crean un compuesto complejo.
Existen diferentes tipos de reacciones químicas. Una reacción de síntesis es aquella que lleva a que dos sustancias distintas (es decir, dos reactivos) se combinen para dar lugar a un único producto. Puede decirse, por lo tanto, que dos elementos sencillos, a través de una reacción de síntesis, se unen y crean un compuesto complejo.
La fórmula de una reacción de síntesis es la siguiente: X + Y = XY. Como es posible advertir, X e Y son dos sustancias químicas diferentes que se combinan para dar lugar a un producto nuevo (XY).
La figura histórica que está considerada como la primera que dio forma real y consciente a las reacciones de síntesis es el químico alemán Friedrich Wholer (1800 – 1882), que consiguió ese resultado a partir de su trabajo con la sustancia orgánica conocida como urea.
Una reacción de síntesis entre un no metal e hidrógeno permite la obtención de un hidrácido, por citar una posibilidad. De manera similar, una reacción de síntesis que combine un no metal con H2O genera un oxiácido, mientras que la combinación de un óxido básico con H2O deriva en un hidróxido.
Lo que sucede en una reacción de síntesis es que, al desarrollarse, se rompen los enlaces químicos que existían entre los reactivos y se forman nuevos enlaces, dando lugar a un compuesto diferente.
Gracias a una reacción de síntesis, por lo tanto, se pueden obtener productos cuyas propiedades serán más marcadas que las originales o incluso que tengan propiedades inexistentes en los reactivos.
Además de todo lo expuesto, hay que saber que las reacciones de síntesis se pueden clasificar en dos grandes grupos: las de síntesis parcial y las de síntesis total. Las primeras son las que tienen lugar cuando los reactivos son sustancias compuestas o bien una mezcla entre compuestas y elementales. Las totales, por su parte, son las que se acometen con sustancias únicamente elementales.
La reacción inversa a la síntesis se conoce como reacción de descomposición: a partir de un único reactivo, se obtienen dos o más productos.
