Definición de oxácido
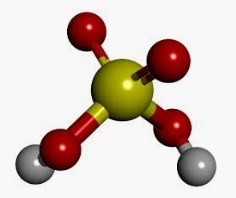 Al ácido que dispone de oxígeno se lo denomina oxácido u oxiácido. Se trata de un compuesto formado por oxígeno, hidrógeno y un elemento no metálico, el cual constituye el átomo central.
Al ácido que dispone de oxígeno se lo denomina oxácido u oxiácido. Se trata de un compuesto formado por oxígeno, hidrógeno y un elemento no metálico, el cual constituye el átomo central.
En los oxácidos, lo habitual es que el oxígeno esté unido al hidrógeno. Su fórmula general es HaXbOc, donde X es un no metal o, en algunas ocasiones, un metal de transición.
Para la formación de un oxácido, un óxido ácido debe reaccionar con el agua. Por ejemplo, cuando el óxido sulfúrico (SO3) reacciona con agua (H2O) se forma el ácido sulfúrico (H2SO4). El ácido sulfúrico es un oxácido.
En este caso del ácido sulfúrico, el oxácido se utiliza para la producción de fertilizantes. También puede emplearse en la elaboración de explosivos, como reactivo en el contexto de una reacción orgánica, como disolvente de compuestos orgánicos, óxidos o metales, como electrólito en baterías y pilas (en especial en las de vehículos motorizados) y en la refinación de petróleo, por mencionar otras posibilidades. Muchas veces el ácido sulfúrico no se encuentra en el producto final, sino que solo se usa como materia prima.
Este oxácido es uno de los más potentes y corrosivos, razón por la cual también se debe manipular con extremas precauciones. A pesar de los riesgos que supone su uso, es el compuesto químico más producido a nivel mundial; tanto es así que se usa para medir la capacidad industrial de las naciones. Por lo general, para obtenerlo es necesario usar dióxido de azufre y óxidos de nitrógeno, haciéndolos atravesar procesos tales como la oxidación y otros que promuevan su concentración.
Otro oxácido es el ácido carbónico (H2CO3), generado cuando el óxido de carbono reacciona con el agua. Cabe mencionar que este ácido deriva del anhídrido carbónico. Esta sustancia se halla en la sangre y las bebidas carbonatadas o gaseosas. Otros de sus usos se dan en la elaboración de tiza y mármol, y también juega un rol de gran importancia en la formación de cuevas.
 Otros nombres por los que se conoce este oxácido son los siguientes: trioxicarbonato de dihidrógeno, ácido trioxocarbónico y trioxocarbonato de hidrógeno. Se trata de un ácido débil, o sea que no se disocia completamente en una disolución acuosa. Gran parte de los minerales que se encuentran en las rocas margosas o calizas son susceptibles a la acción de este ácido, que puede descomponerlos en bicarbonato de calcio u otras sales. Como dato curioso, basta con la existencia de una molécula de agua para que se descomponga inmediatamente en dióxido de carbono y agua.
Otros nombres por los que se conoce este oxácido son los siguientes: trioxicarbonato de dihidrógeno, ácido trioxocarbónico y trioxocarbonato de hidrógeno. Se trata de un ácido débil, o sea que no se disocia completamente en una disolución acuosa. Gran parte de los minerales que se encuentran en las rocas margosas o calizas son susceptibles a la acción de este ácido, que puede descomponerlos en bicarbonato de calcio u otras sales. Como dato curioso, basta con la existencia de una molécula de agua para que se descomponga inmediatamente en dióxido de carbono y agua.
El ácido crómico (H2Cr2O4), en tanto, suele ser el resultado de mezclar dicromato de potasio o amonio con ácido sulfúrico, y es posible que contenga varios compuestos, como ser trióxido de cromo sólido. Esto significa que con este mismo nombre podemos encontrar más de una sustancia. Se aprovecha en procesos de coloreado y cromado. Otra aplicación frecuente es la limpieza de materiales de laboratorio, especialmente de productos de cristal. Es importante mencionar que, debido al riesgo que este compuesto supone para el medio ambiente y para la salud, el uso de este oxácido se ha limitado.
Otro compuesto químico que responde al nombre de ácido crómico (más específicamente, ácido crómico molecular) se consigue usando como anhídrido el anterior, y su fórmula es H2CrO4. En este caso, el cromo se presenta en un estado de oxidación VI. Tiene una acción corrosiva y oxidante de una fuerza considerable, por lo cual debe manipularse tomando las precauciones necesarias.
Como se puede advertir, los oxácidos se emplean de múltiples modos. Cada uno tiene sus características y, por eso, resulta apropiado para cierto fin.
