Definición de covalente
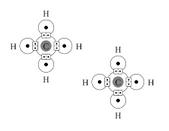 El adjetivo covalente se emplea en el ámbito de la química para calificar al enlace que se genera entre átomos que tienen pares de electrones compartidos. También se califica como covalente a aquello que cuenta con al menos un enlace covalente.
El adjetivo covalente se emplea en el ámbito de la química para calificar al enlace que se genera entre átomos que tienen pares de electrones compartidos. También se califica como covalente a aquello que cuenta con al menos un enlace covalente.
Es importante recordar que las partículas que tienen carga eléctrica y están formadas por una molécula o un átomo que no es neutro reciben el nombre de iones. Los iones, de acuerdo a la regla del octeto que enunció el estadounidense Gilbert Newton Lewis en 1916, tienen la tendencia de emplear ocho electrones para completar los últimos niveles de energía y así lograr estabilidad en su configuración.
Los átomos, para respetar la regla del octeto, pueden apelar a distintas clases de enlaces químicos para unirse. Entre ellas aparece el enlace covalente, que supone la compartición de electrones en el último nivel. Este tipo de enlace requiere que la diferencia de electronegatividad que se registra entre los átomos sea inferior a 1,7.
Los enlaces covalentes se desarrollan entre átomos de distintos elementos no metales y entre átomos que pertenecen a un mismo elemento no metal. Los átomos enlazados de manera covalente comparten sus pares de electrones en el orbital molecular.
Estos átomos pueden compartir entre uno y tres pares de electrones en un enlace covalente: por lo tanto, los enlaces pueden ser simples, dobles o triples según el caso. Si el enlace se produce entre átomos iguales que presentan una diferencia de electronegatividad inferior a 0,4, se obtiene un enlace covalente apolar. En cambio, si el enlace es desarrollado por átomos de distintos elementos que tienen una diferencia de electronegatividad mayor a 0,4, se trata de un enlace covalente polar.
De acuerdo con lo químicos G. William Daub y S. Seese, en cualquier sustancia covalente (como puede ser una molécula de hidrógeno) se aprecian los siguientes cuatro aspectos:
* si se observan de forma individual, es decir fuera de una combinación, los átomos poseen propiedades muy diferentes a las que exhiben las moléculas. Por esta razón, al escribir la fórmula química del hidrógeno, por ejemplo, debemos poner un dos como subíndice de la H, ya que se trata de una molécula diatómica (aquélla que está formada por dos átomos, sean o no del mismo elemento químico);
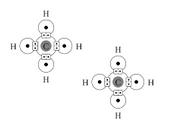 * los dos electrones se ven atraídos por los dos núcleos positivos, algo que ocurre con el objetivo de que se produzca una molécula más estable que una en la cual los átomos estén separados. Esto provoca que se genere un enlace covalente. Dado que la atracción a la que los núcleos someten a los electrones consigue anular la repulsión entre ellos, hay muchas probabilidades de hallar electrones entre los dos núcleos;
* los dos electrones se ven atraídos por los dos núcleos positivos, algo que ocurre con el objetivo de que se produzca una molécula más estable que una en la cual los átomos estén separados. Esto provoca que se genere un enlace covalente. Dado que la atracción a la que los núcleos someten a los electrones consigue anular la repulsión entre ellos, hay muchas probabilidades de hallar electrones entre los dos núcleos;
* la distancia que hay entre los núcleos tiene que permitir que las orbitales 1s tengan el máximo solapamiento. Por ejemplo, este valor en la molécula de hidrógeno ronda los 0,74 ángstrom. Si esto no se cumple, entonces se habla de longitud de enlace para definir la distancia que hay entre dos átomos unidos de forma covalente;
* son necesarias 52 kilocalorías para cortar los enlaces covalentes que existen en 1 gramo de hidrógeno gaseoso.
Con respecto a las sustancias covalentes, es posible reconocer las siguientes dos:
* las covalentes moleculares, es decir los enlaces que forman moléculas con temperaturas de ebullición y fusión bajas, aislantes del calor y la corriente eléctrica, solubles en disolventes polares o apolares (según sean polares o apolares las propias moléculas), como ser el benceno, el nitrógeno, el oxígeno y el carbono;
* las covalentes reticulares, redes cristalinas con un número de átomos indefinido, parecidos a los compuestos iónicos, caracterizados por ser muy duros, insolubles y con altas temperaturas de ebullición y fusión, como el diamante y el cuarzo.
