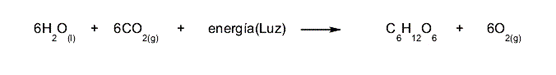Reacciones endotérmicas
Te explicamos qué son las reacciones endotérmicas y algunos ejemplos de ellas. Además, qué son las reacciones exotérmicas.

¿Qué son las reacciones endotérmicas?
Las reacciones endotérmicas son reacciones químicas que necesitan el suministro de energía calórica para que ocurran. Para que los reactivos se transformen en productos, estas reacciones absorben calor, lo que hace que los productos obtenidos queden con mayores niveles de energía que los reactivos iniciales.
La entalpía es una magnitud que define el flujo de energía térmica en los procesos químicos que ocurren a presión constante. Además, esta magnitud representa el intercambio de energía entre un sistema termodinámico y su entorno. La variación de esta magnitud (ΔH) en una reacción química se utiliza para clasificar a la reacción en endotérmica o exotérmica.
ΔH>0 reacción endotérmica.
ΔH<0 reacción exotérmica.
Estas reacciones son de uso común en la industria del hielo químico y del enfriamiento, ya que pueden generarse en ambientes controlados para retirar calor de los ambientes o de otras sustancias. Algunas de sus aplicaciones fueron reemplazadas con el frío generado por los equipos de enfriamiento.
Ver también: Principio de conservación de la energía
Ejemplos de reacciones endotérmicas

Algunos ejemplos de reacciones endotérmicas son:
- La producción de ozono en la atmósfera. Esta reacción es impulsada por la radiación ultravioleta del Sol, las moléculas de oxígeno (O2) son convertidos en ozono (O3), absorbiendo energía de dicha radiación en el proceso.
![]()
- La electrólisis del agua. Para separar el hidrógeno (H) y el oxígeno (O) que componen el agua (H2O) es necesario añadir energía eléctrica en un procedimiento conocido como electrólisis, en el cual ambos tipos de átomos responden a los polos generados por la corriente eléctrica añadida, se rompe su enlace químico y se consume energía.
![]()
- La fotosíntesis. El proceso de nutrición de las plantas se da a través de una serie de reacciones químicas que descomponen el dióxido de carbono (CO2) ambiental en presencia de agua y luz solar. Esta serie de reacciones necesita consumir energía para ocurrir.
![]()
- La obtención de sulfuro de hierro (II). Este compuesto se obtiene en un laboratorio después de hacer reaccionar hierro y azufre. Para que esta reacción ocurra es necesario suministrar energía calórica usando un mechero (o una caldera si se trata de condiciones industriales).
![]()
Reacciones exotérmicas

Una reacción exotérmica es aquella que cuando ocurre libera energía en forma de calor o luz al ambiente. Cuando este tipo de reacción ocurre, los productos obtenidos tienen menor energía que los reactivos iniciales. La variación de entalpía para este tipo de reacciones es menor que cero (ΔH<0).
Son ejemplo de este tipo de reacciones todas las formas de combustión y de oxidación, como es el caso de la gasolina o los combustibles fósiles, que al ser quemados en presencia de oxígeno liberan una cantidad de energía muy superior a la introducida inicialmente (el chispazo del motor). Lo mismo ocurre en los cambios de fase de la materia del estado gaseoso al líquido, o del líquido al sólido.
Más en: Reacción exotérmica
Referencias
- “Reacción endotérmica y exotérmica” en el Portal Académico CCH de la Universidad Nacional Autónoma de México (UNAM).
- “Reacción exotérmica” en EcuRed, Conocimiento con todos y para todos.
- “Obtención de amoníaco” en LaGuía.