Producto en Química
Te explicamos qué es un producto en química, el proceso por el cual se obtiene un producto y cómo calcular el rendimiento de una reacción.

¿Qué es un producto en química?
En la química y sus ramas, se conoce como producto a las sustancias obtenidas luego de ocurrir una reacción química.
En una reacción química intervienen dos o más sustancias (simples o compuestas), denominadas reactantes o reactivos, y que aportan a la reacción el material atómico o molecular que será alterado o modificado durante la reacción.
Una vez modificados los enlaces químicos de los reactivos, y generada o consumida cierta cuota de energía cuando ocurre la reacción, tendremos uno o más productos disponibles.
Los productos que se obtienen a partir de cierto tipo de reactivos dependerán directamente de las condiciones en que ocurra la reacción química y de la naturaleza de los reactivos. Condiciones como temperatura o presencia de catalizadores (otras sustancias que inciden en la velocidad de la reacción) son determinantes en el tiempo que toma en producirse una reacción.
No obstante, sea cual sea la reacción química considerada y las condiciones en que ocurra, la cantidad de materia y energía debe conservarse, es decir, la cantidad de reactivos (átomos, moléculas, iones) que reaccionan debe ser igual a la cantidad de productos formados, y la energía involucrada al inicio de la reacción debe ser igual a la energía involucrada al final de la reacción, ya sea esta energía consumida o liberada en cualquiera de las etapas de la reacción.
Es muy importante entender que durante una reacción química la cantidad de materia y energía de los reactivos no se crea ni se destruye para convertirse en productos, solo se transforma en ellos.
Ver además: Reacción exotérmica
Rendimiento de una reacción
Del mismo modo, las cantidades formadas (reales) de producto nunca suelen ser idénticas a las consideradas teóricamente, dado que en ello influyen propiedades puntuales como la pureza de los reactivos o las reacciones secundarias que se produzcan, así como también, las condiciones ambientales en que se genere la reacción, por ejemplo, la temperatura y la humedad.
Las cantidades de producto reales (los obtenidos en la práctica y no como resultado de un cálculo teórico) son menores que las teóricas porque, debido a las razones anteriores, se puede perder producto en pasos de purificación sucesivos a la reacción, en reacciones secundarias donde intervengan estos productos o en evaporaciones si son volátiles.
La cantidad máxima de producto que se puede obtener durante una reacción química se denomina rendimiento teórico. Para calcular el rendimiento teórico es necesario conocer el reactivo limitante en la reacción (reactivo que se agota primero durante la reacción).
La cantidad de producto real que se obtiene en una reacción química se denomina rendimiento porcentual.
En el siguiente ejemplo veremos cómo calcular el rendimiento teórico y el rendimiento porcentual de una reacción química, en la que habrá que identificar el reactivo limitante.
Supongamos que tenemos la siguiente reacción donde reaccionan 2,80 g de aluminio con 4,25 g de dicloro:
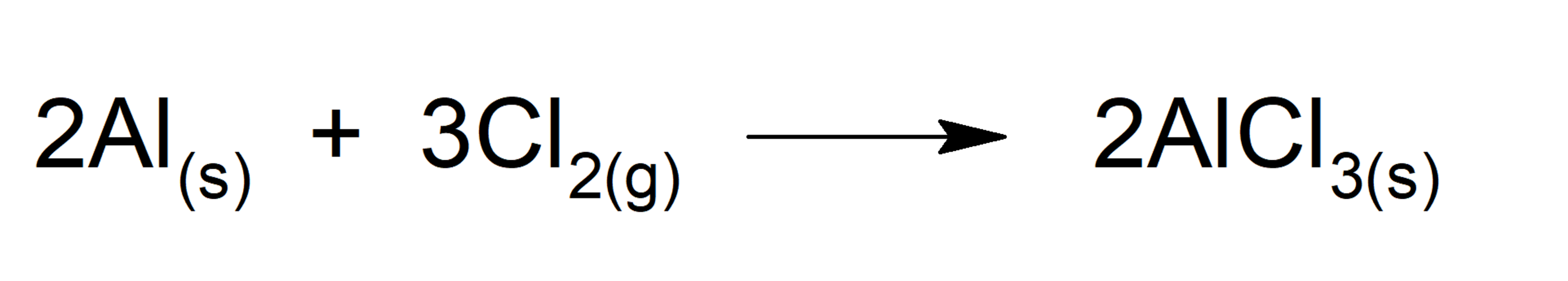
Existen diferentes métodos para identificar el reactivo limitante y es importante aclarar que el reactivo limitante no necesariamente es el reactivo que mayor masa tiene al iniciar la reacción. Describiremos dos de estos métodos:
Método 1. Consiste en calcular la cantidad de moles reales de los reactivos utilizando las masas reales y las masas molares (M(Al) y M(Cl2 ) en este caso) de cada reactivo. Después, se calcula la relación molar (cociente entre cantidades de sustancias (moles)) real entre los reactivos, es decir, usando las masas iniciales. Luego, se compara esta relación molar real con la relación estequiométrica de los reactivos en la ecuación balanceada (calculada utilizando los coeficientes estequiométricos).

Se puede ver que la relación real es mayor que la relación estequiométrica, por lo que el aluminio (cuyo número de moles están ubicados en el numerador del cociente) está en exceso y el dicloro es el reactivo limitante.
Método 2. En este método empleamos la definición de mol de reacción. Se obtiene un mol de reacción cuando reaccionan los coeficientes estequiométricos de la ecuación química ajustada o balanceada. En la reacción que estamos analizando se obtiene 1 mol de reacción cuando reaccionan 2 moles de aluminio con 3 moles de dicloro para producir 2 moles de AlCl3, lo que se puede representar en las siguientes ecuaciones:
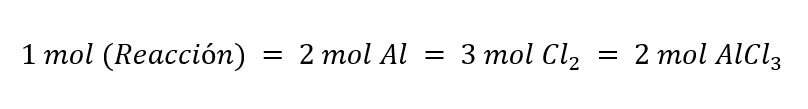
De este modo, una reacción ocurre más veces mientras más moles de reacción tenga. El reactivo con menor cantidad de moles de reacción es el limitante, pues con este reactivo la reacción puede ocurrir menor cantidad de veces.
Utilizando los moles de reacción y los moles de reactivo se puede identificar el reactivo limitante de la siguiente forma:

Según este método, el Cl2 también es el reactivo limitante, pues genera menor cantidad de moles de reacción.
Una vez que sabemos que el dicloro es el reactivo limitante, podemos calcular el rendimiento teórico como:
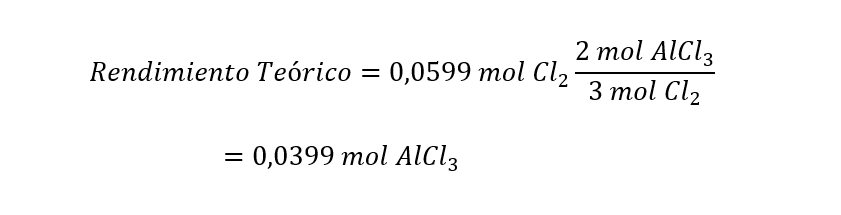
Luego, convertimos los moles del rendimiento teórico a gramos, utilizando la masa molar del AlCl3 (M(AlCl3 )), para después calcular el rendimiento porcentual:

Finalmente, el rendimiento porcentual o real de una reacción química se calcula:

Y para el ejemplo que estamos analizando sería:

Referencias
- «Reactivos limitantes y rendimiento porcentual» en Khan Academy.
