Energía interna: concepto, función, cómo calcularla, ejemplos
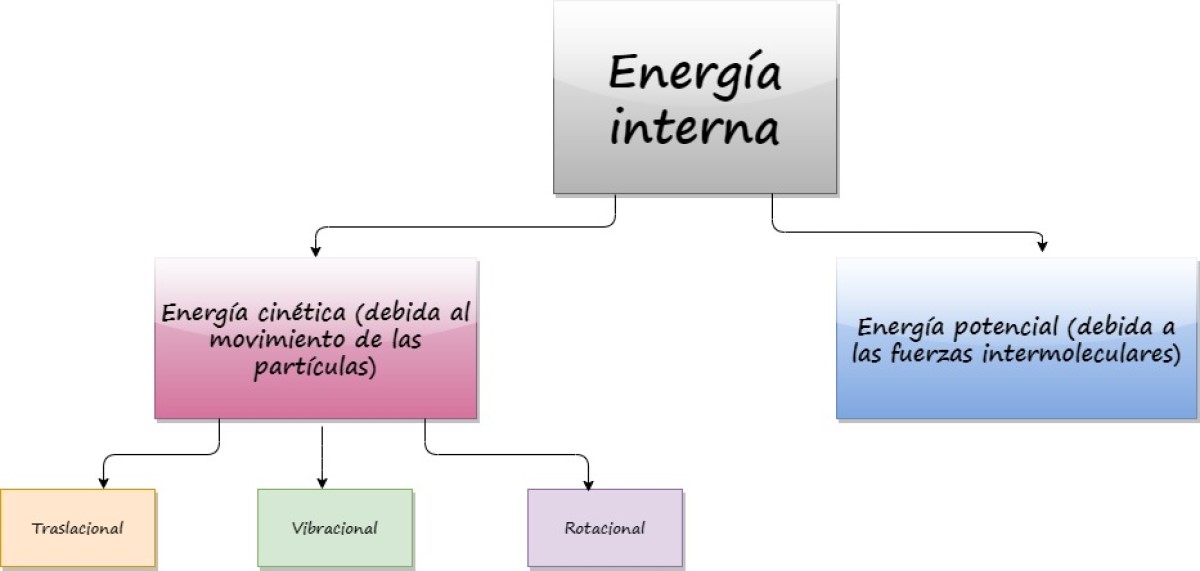
¿Qué es la energía interna?
La energía interna de un objeto proviene del movimiento al azar que tienen los átomos y las moléculas que lo componen. Aun cuando el objeto se encuentre perfectamente en reposo, en su interior, a nivel microscópico, las partículas que lo componen se mueven continuamente sin descanso.
Puesto que estas partículas están en movimiento, poseen energía cinética, la cual forma parte de su energía interna. La otra contribución a la energía interna es la energía potencial que proviene de las fuerzas intermoleculares, encargadas de mantener la cohesión de la sustancia.
Estas fuerzas intermoleculares por lo general son de origen electromagnético, pero también participan las fuerzas gravitatorias y nucleares.
Ahora bien, según el tipo de movimiento de las partículas, la energía cinética puede ser:
- Traslacional
- Vibracional
- Rotacional
La temperatura mide únicamente la energía cinética traslacional de las partículas. En principio, a mayor temperatura, mayor será la energía interna, pero esto también depende de la masa. Un ejemplo aclara la cuestión: un vaso con agua tibia tiene menos energía interna que un lago a temperatura ambiente, aunque la temperatura del vaso sea mayor, y eso se debe a que hay más agua en el lago que en el vaso.
En cualquier caso, la energía interna de una sustancia no es perceptible a la vista, no depende de su movimiento, ni tampoco depende de su posición relativa con respecto a otros objetos. Por ejemplo, la energía interna de un vaso con agua a temperatura ambiente es la misma si el vaso está sobre una mesa o si está sobre el piso.
Función de la energía interna
La energía interna, que usualmente se denota como U, es una función que depende de las variables termodinámicas del sistema, como pueden ser la temperatura T y el volumen V. Por lo tanto, se puede expresar matemáticamente como:
U = U (T, V)
En realidad, el valor absoluto de la energía interna de un sistema no es relevante, lo que importa es su variación, la cual se denota con la letra griega Δ (“delta”):
ΔU = U inicial – U final
Ahora bien, la energía interna puede variarse si se añade o se extrae calor al sistema. Añadiendo calor es posible que el sistema haga un determinado trabajo, como por ejemplo un pistón en el cilindro de un motor.
La primera ley de la termodinámica
A partir de la primera ley de la termodinámica se establece que la variación de la energía interna de un sistema equivale a:
ΔU = Q – W
Donde Q es la cantidad de calor que se transfiere al sistema y W es el trabajo que el sistema hace, en caso de que realice alguno. Todo se mide en joules en el Sistema Internacional de unidades.
Si el sistema no hace trabajo, entonces el calor suministrado se emplea en su totalidad para aumentar la energía interna del sistema.
De la expresión anterior se deduce lo siguiente:
- ΔU > 0 significa que el sistema aumenta su energía interna
- ΔU 0 la energía interna del sistema disminuye
- Q > 0 el sistema absorbe calor
- W > 0 el sistema realiza trabajo.
¿Cómo calcular la energía interna?
El gas ideal monoatómico
En el modelo de gas ideal monoatómico (un solo átomo), las partículas no interactúan entre sí, de manera que la energía cinética traslacional es la única contribución a la energía interna U del gas. Existe un teorema, llamado teorema de la equipartición, que afirma que cada grado de libertad tiene una energía igual a:
Donde T es la temperatura y R es la constante de los gases ideales, cuyo valor en unidades del Sistema Internacional es:
8.314472 J/mol∙K
Un grado de libertad representa la posibilidad de trasladarse a lo largo una cierta dirección en el espacio. Una partícula de gas ideal puede moverse en las tres direcciones del espacio, por lo tanto, la energía de n moles de gas es:
Cantidad de calor
Suponiendo que se agrega calor a un sistema y este no realiza trabajo, este calor se utiliza únicamente en aumentar la energía interna del sistema. La cantidad de calor Q debe ser proporcional a la masa m del sistema y al cambio de temperatura:
Q ∝ m⋅ΔT
La constante de proporcionalidad depende de la sustancia y se llama calor específico. Llamando c a esta constante, el calor es:
Q = mc⋅ΔT
Como el calor se invierte en aumentar la energía interna:
Q = mc⋅ΔT = ΔU
ΔU corresponde a la variación en la energía interna.
Ejemplos de energía interna
1. Variaciones de temperatura
Los cambios en la temperatura de las sustancias generan a su vez cambios en su energía interna. Es lo que sucede, por ejemplo, al cocinar. Al calentar la comida, la agitación de sus moléculas aumenta, la energía cinética se incrementa y por ende lo hace su energía interna.
2. Energía interna de dos sustancias a igual temperatura
Dos sustancias a igual temperatura no necesariamente tienen la misma energía interna, ya que esta depende de dos contribuciones: la energía cinética y la energía potencial.
Si las sustancias están a igual temperatura, se puede afirmar que la energía cinética traslacional de sus partículas es la misma, pero la energía potencial es diferente, ya que esta depende de la configuración de los átomos constituyentes.
3. Expansión térmica
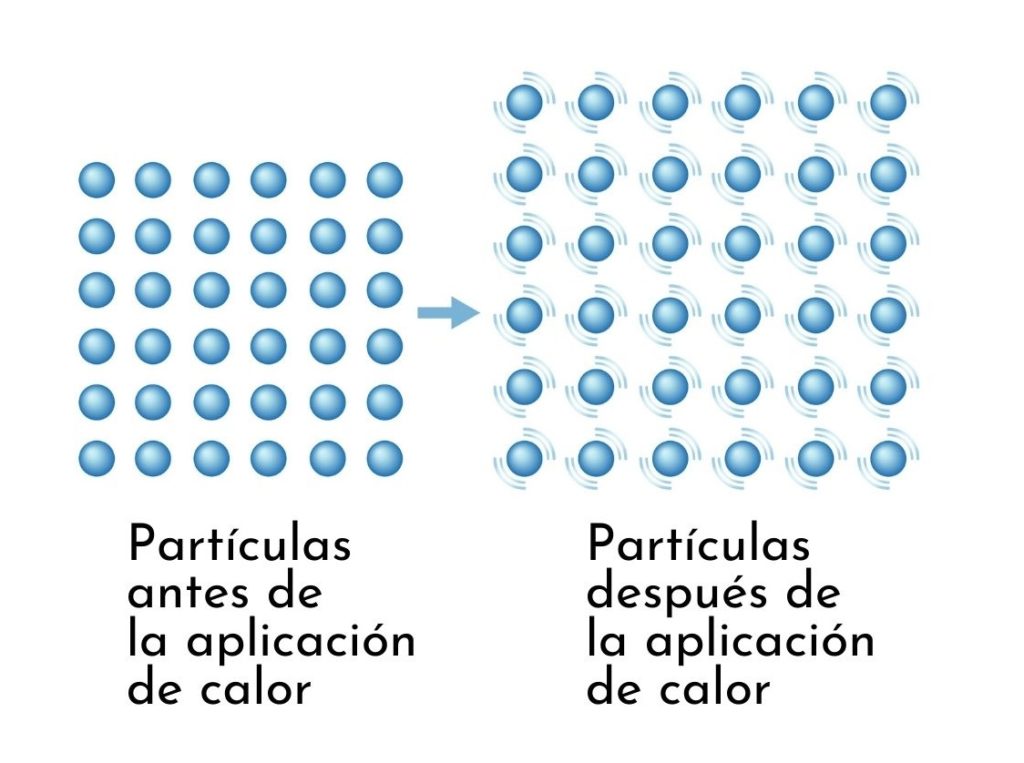
Una consecuencia visible de calentar las sustancias es el aumento en sus dimensiones, ya que la distancia promedio entre sus átomos se incrementa.
Las fuerzas intermoleculares pueden simularse a través de resortes que unen a los átomos, un aumento en la temperatura hace que aumente la amplitud de la vibración, en consecuencia, la separación entre átomos es mayor, resultando en la expansión el objeto.
4. Gases comprimidos
Los gases comprimidos pueden almacenar energía interna, ya que su densidad aumenta al disminuir el volumen y con ello sus interacciones con las paredes del recipiente contenedor. De esta forma un gas comprimido es capaz de hacer un trabajo como por ejemplo mover un pistón.
5. Baterías
En una batería ocurren reacciones químicas capaces de generar una corriente eléctrica en cuanto se cierra el circuito. Esta energía potencial química se considera como parte de la energía interna del sistema.
6. Sistema que absorbe calor y hace trabajo
Cuando un sistema absorbe calor, aumenta su energía interna. Pero si a la vez realiza un trabajo, se puede utilizar la primera ley de la termodinámica para saber en cuánto cambia la energía interna. Por ejemplo, suponiendo que un sistema absorbe 175 J de calor y realiza un trabajo equivalente a 62 J, el cambio en su energía interna es:
ΔU = Q – W = 175 J – 62 J = 113 J.
