Benceno: historia, estructura, propiedades, derivados, usos
El benceno es un compuesto orgánico que consiste en uno de los hidrocarburos aromáticos más simples de todos. Su fórmula química es C6H6, de la cual se sabe que la relación entre carbono e hidrógeno es igual a 1; es decir, que por cada carbono hay un hidrógeno enlazado a este.
Aunque su apariencia física sea la de un líquido incoloro, se halla naturalmente en el petróleo y los productos derivados del mismo. Su olor resulta muy característico, pues se asemeja a una mezcla de pegamento, betún y gasolina; por otro lado, se trata de un líquido volátil e inflamable.

En la imagen superior se muestra un recipiente o frasco con benceno, presumiblemente de una pureza no analítica. Si se destapara, inmediatamente los vapores del benceno se esparcirían por todo el laboratorio. Por esta razón este líquido, empleado comúnmente como simple solvente, se manipula dentro de una campana extractora de gases.
Al ser su fórmula C6H6, los químicos del siglo XIX plantearon numerosas estructuras posibles que correspondieran a dicha proporción C/H igual a 1. No solo esto, sino que la molécula de benceno debía tener enlaces especiales de tal manera que pudiera explicarse su inusual estabilidad frente a las reacciones de adición; típicas para los alquenos y polienos.
Fue así que sus enlaces representaron un enigma para los químicos de entonces; hasta que se introdujo la propiedad llamada aromaticidad. Antes considerado un hexaciclotrieno (con tres enlaces C=C), el benceno es mucho más que eso, y es otro de los tantos ejemplos de sinergia en la química.
En química orgánica, el benceno es un símbolo clásico, base estructural para múltiples compuestos poliaromáticos. De su hexágono se obtienen sinfines de derivados vía sustitución electrofílica aromática; un anillo de cuyos bordes se trama la estructura que define nuevos compuestos.
De hecho, a sus derivados se le debe los vastos usos industriales para los que necesitan benceno entre su materia prima. Desde la preparación de pegamentos y fibras textiles, hasta plásticos, cauchos, pigmentos, fármacos y explosivos. Por otro lado, naturalmente el benceno se encuentra en los volcanes, incendios forestales, gasolina y en el humo de los cigarrillos.
Índice del artículo
- 1 Historia
- 2 Estructura del benceno
- 3 Propiedades
- 3.1 Masa molecular
- 3.2 Apariencia física
- 3.3 Punto de ebullición
- 3.4 Punto de fusión
- 3.5 Punto de ignición
- 3.6 Temperatura de auto ignición
- 3.7 Densidad
- 3.8 Solubilidad
- 3.9 Densidad de vapor
- 3.10 Presión de vapor
- 3.11 Calor de combustión
- 3.12 Calor de vaporización
- 3.13 Tensión superficial
- 3.14 Índice de refracción
- 4 Derivados
- 5 Usos
- 6 Nomenclatura
- 7 Toxicidad
- 8 Referencias
Su descubrimiento se remonta a 1825, adjudicado normalmente a Michael Faraday, cuando recolectó e hizo experimentos con un aceite remanente producto del gas utilizado para la iluminación. Este líquido contenía una proporción C/H cercana a 1, razón por la que lo llamó ‘hidrógeno carburado’.
El químico Auguste Laurent nombró al extraño hidrocarburo ‘feno’, derivado de la palabra griega ‘phaínein’ que significa brillante (debido a que se obtenía después de que el gas ardiera). Sin embargo, dicho nombre no fue aceptado por la comunidad científica y prevaleció únicamente como ‘fenil’, para referirse al radical derivado del benceno.
A partir de la goma de benzoína el químico Eilhard Mitscherlich, nueve años después, logró producir el mismo compuesto; se tenía por tanto otra fuente para el mismo hidrocarburo, al cual bautizó como ‘bencina’. No obstante, tampoco consideraron el nombre apropiado por asumir que se trataba de un alcaloide, como la quinina.
Así, sustituyeron el nombre ‘bencina’ por ‘benzol’. Empero, nuevamente hubo contradicciones y discrepancias a raíz de que el término ‘benzol’ confundía al hidrocarburo por un alcohol. Fue entonces cuando nació el nombre ‘benceno’, empleado primeramente en Francia e Inglaterra.
Ni el gas de iluminación ni la goma de benzoína eran fuentes apropiadas para generar el benceno a grandes escalas. Charles Mansfield, trabajando con August Wilhelm von Hofmann, logró en 1845 aislar el benceno (veinte años después de su descubrimiento) del alquitrán de hulla, producto lateral de la producción de coque.
Fue así que inició la producción industrial de benceno a partir del alquitrán de hulla. La disponibilidad del benceno en masivas cantidades, facilitó el estudio de sus propiedades químicas y permitió relacionarlo con otros compuestos de reactividades similares. El mismo August Wilhelm von Hofmann acuñó la palabra ‘aromático’ para el benceno y los compuestos afines.
El sueño de August Kekulé
A Friedrich August Kekulé se le adjudica la estructura hexagonal y cíclica del benceno alrededor del año 1865, surgida de un extraño sueño con Uroboros, la serpiente que muerde su propia cola dibujando un círculo. Así, creía que el benceno podía considerarse como un anillo hexagonal, y otros químicos plantearon posibles estructuras, las cuales se muestran abajo:
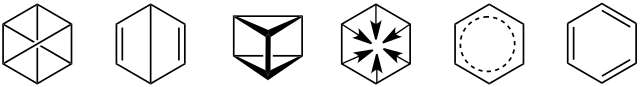
Alguna de las estructuras superiores podían justificar la estabilidad del benceno.
Libro, anillos y prisma
Nótese que la tercera estructura ni siquiera es un anillo sino un prisma triangular, propuesto por Albert Ladenburg en 1869; a su izquierda, una con forma de libro abierto, propuesta por Sir James Dewar en 1867; y a su derecha, una con todos los hidrógenos dirigidos hacia el centro del anillo, propuesta por Henry Edward Armstrong en 1887.
La primera estructura, propuesta por Adolf Karl Ludwig Claus en 1867, también es bastante peculiar, pues los enlaces C-C se encuentran cruzados. Y la última, fue el anillo “serpentino” de Kekulé, soñado en 1865.
¿Cuál fue la “ganadora”? La quinta estructura (de izquierda a derecha), propuesta en 1899 por Johannes Thiele.
En esta se consideró por vez primera el híbrido de resonancia, el cual combinaba las dos estructuras de Kekulé (voltee el primer anillo de la derecha para observarla) y explicaba extraordinariamente la deslocalización de los electrones y, con ello, la hasta entonces inusual estabilidad del benceno.
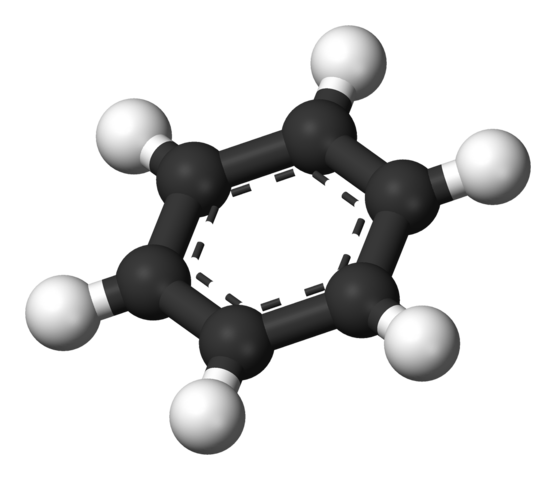
Arriba se muestra la estructura propuesta por Thiele mediante un modelo de esferas y barras.
La molécula de benceno es plana, con los átomos de hidrógeno apuntando hacia afuera de los laterales del anillo. Todos los átomos de carbono tienen hibridación sp2, con un orbital p disponible para establecer el sistema aromático en el que deslocalizan seis electrones.
Estos carbonos sp2 son más electronegativos que los hidrógenos, y por lo tanto, los primeros retiran densidad electrónica a los segundos (Csp2δ--Hδ+). En consecuencia, el centro del anillo presenta una mayor concentración de electrones que sus laterales.
Más precisamente, el sistema aromático puede representarse como una nube o almohadilla electrónica dilatada por ambas caras del anillo hexagonal; y en el medio, por los laterales o bordes, una deficiencia electrónica conformada por hidrógenos con carga parcial positiva.
Gracias a esta distribución de las cargas eléctricas, las moléculas de benceno pueden interactuar entre sí mediante fuerzas dipolo-dipolo; los átomos Hδ+ sienten atracción por el centro aromático de un anillo vecino (más abajo se representará esto).
Asimismo, los centros aromáticos pueden apilarse uno encima de otro para favorecer la inducción de los dipolos instantáneos.
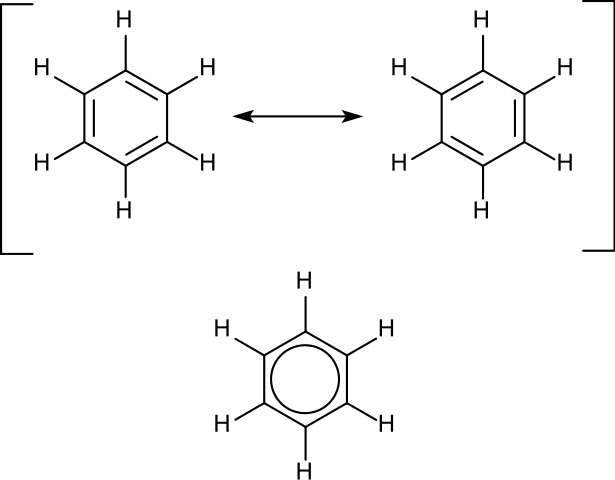
En la parte superior de la imagen se muestran las dos estructuras de Kekulé, y debajo de ellas, el híbrido de resonancia. Como las dos estructuras se suceden una y otra vez en un mismo tiempo, el híbrido se representa con un círculo dibujado en el medio (similar al de una “rosquilla hexagonal”).
El círculo del híbrido es importante porque indica el carácter aromático del benceno (y el de otros tantos compuestos). Además, señala que los enlaces no son tan largos como C-C, ni tampoco tan cortos como C=C; sino que la longitud de los mismos se encuentra entre ambos extremos. Es así que al benceno no se le considera un polieno.
Lo dicho anteriormente se ha demostrado por la medición de las longitudes de los enlaces C-C (139 pm) del benceno, los cuales son un poco más alargados que los enlaces C-H (109 pm).
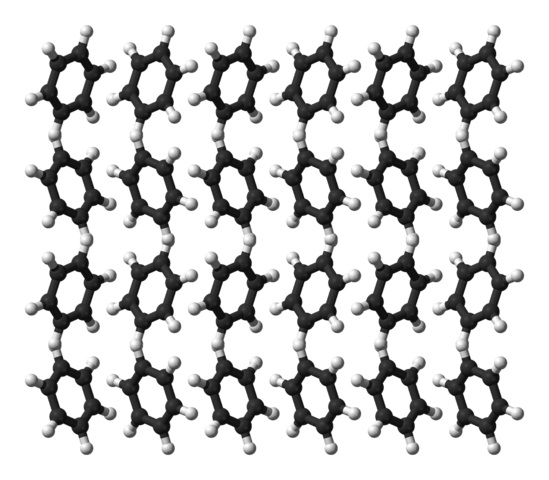
El benceno es un líquido a temperatura ambiente. Sus fuerzas intermoleculares hacen que, pese no tener un momento dipolar tan pronunciado, pueda mantener unidas sus moléculas en un líquido que hierve a 80ºC. Cuando la temperatura desciende por debajo de los 5ºC, el benceno comienza a congelarse: y así se obtienen sus correspondientes cristales.
Los anillos de benceno pueden adoptar patrones estructurales definidos en su sólido. Sus dipolos hacen que se “ladeen” hacia la izquierda o derecha, formando filas capaces de reproducirse mediante una celda unitaria ortorrómbica. Así pues, los cristales de benceno son ortorrómbicos.
Nótese en la imagen superior que al inclinarse los anillos se favorecen las interacciones entre los Hδ+ y los centros aromáticos, mencionadas en subapartados anteriores.
78,114 g/mol.
Líquido incoloro con un olor parecido al de la gasolina.
80ºC.
5,5ºC.
-11ºC (copa cerrada).
497,78ºC.
0,8765 g/mL a 20ºC.
Un litro de agua hirviendo apenas puede disolver 3,94 g de benceno. Su carácter apolar lo hace prácticamente inmiscible con el agua. Sin embargo, sí es miscible con otros solventes, tales como etanol, éteres, acetona, aceites, cloroformo, tetracloruro de carbono, etc.
2.8 en relación al aire (es decir, casi tres veces más denso).
94,8 mm Hg a 25ºC.
-3267,6 kJ/mol (para el benceno líquido).
33,83 kJ/mol.
28,22 mN/m a 25ºC.
1,5011 a 20ºC.
Los hidrógenos del benceno pueden ser sustituidos por otros grupos o átomos. Puede haber una o más sustituciones, aumentando el grado de sustitución hasta que de los seis hidrógenos originales no quede ninguno.
Por ejemplo, asúmase el benceno como Ph-H, donde H es cualquiera de sus seis hidrógenos. Recordando que el centro del anillo tiene mayor densidad electrónica, atrae electrófilos, los cuales atacan al anillo para sustituir al H en una reacción llamada sustitución electrofílica aromática (SEAr).
Si este H se sustituye por un OH, se tendrá el Ph-OH, fenol; sustituyéndose por un CH3, Ph-CH3, tolueno; si se trata del NH2, Ph-NH2, anilina; o si es el CH2CH3, Ph-CH2CH3, etilbenceno.
Los derivados pueden ser iguales o más tóxicos que el benceno, o por el contrario tornarse tan complejos que lleguen a ejercer un efecto farmacológico deseable.
Es un buen solvente para una amplia variedad de compuestos, presentes por ejemplo en las pinturas, barnices, adhesivos y revestimientos.
Asimismo, puede disolver aceites, grasas o ceras, por lo que se ha usado como solvente extractor de esencias. Esta propiedad llegó a utilizarse por Ludwig Roselius en 1903 para descafeinar el café, operación ya en desuso por la toxicidad del benceno. Igualmente, se utilizó en el pasado para desengrasar metales.
En uno de sus usos clásicos no actúa como solvente sino como aditivo: aumentar el octanaje de la gasolina, sustituyendo al plomo para este fin.
Los derivados del benceno pueden tener distintos usos; algunos sirven como pesticidas, lubricantes, detergentes, plásticos, explosivos, perfumes, colorantes, pegamentos, drogas, etc. Si en su estructura se observa un anillo bencénico, es bastante probable que su síntesis haya partido del benceno.
Entre sus derivados más importantes están: cumeno, xileno, anilina, fenol (para la síntesis de resinas fenólicas), ácido benzoico (conservante), ciclohexano (para la síntesis del nilón), nitrobenceno, resorcinol y etilbenceno.
La nomenclatura de los derivados del benceno varía dependiendo del grado de sustitución, de cuáles son los grupos sustituyentes, y de sus posiciones relativas. Así, el benceno puede sufrir mono, di, tri, tetra, etc., sustituciones
Cuando los dos grupos están enlazados a carbonos adyacentes, se utiliza la denominación ‘orto’; si hay un carbono de por medio separándolos, ‘meta’; y si los carbonos están en posiciones opuestas, ‘para’.
En las imágenes inferiores se muestran ejemplos de derivados de bencenos con sus nombres respectivos regidos por la IUPAC. Asimismo, están acompañados por los nombres comunes o tradicionales.
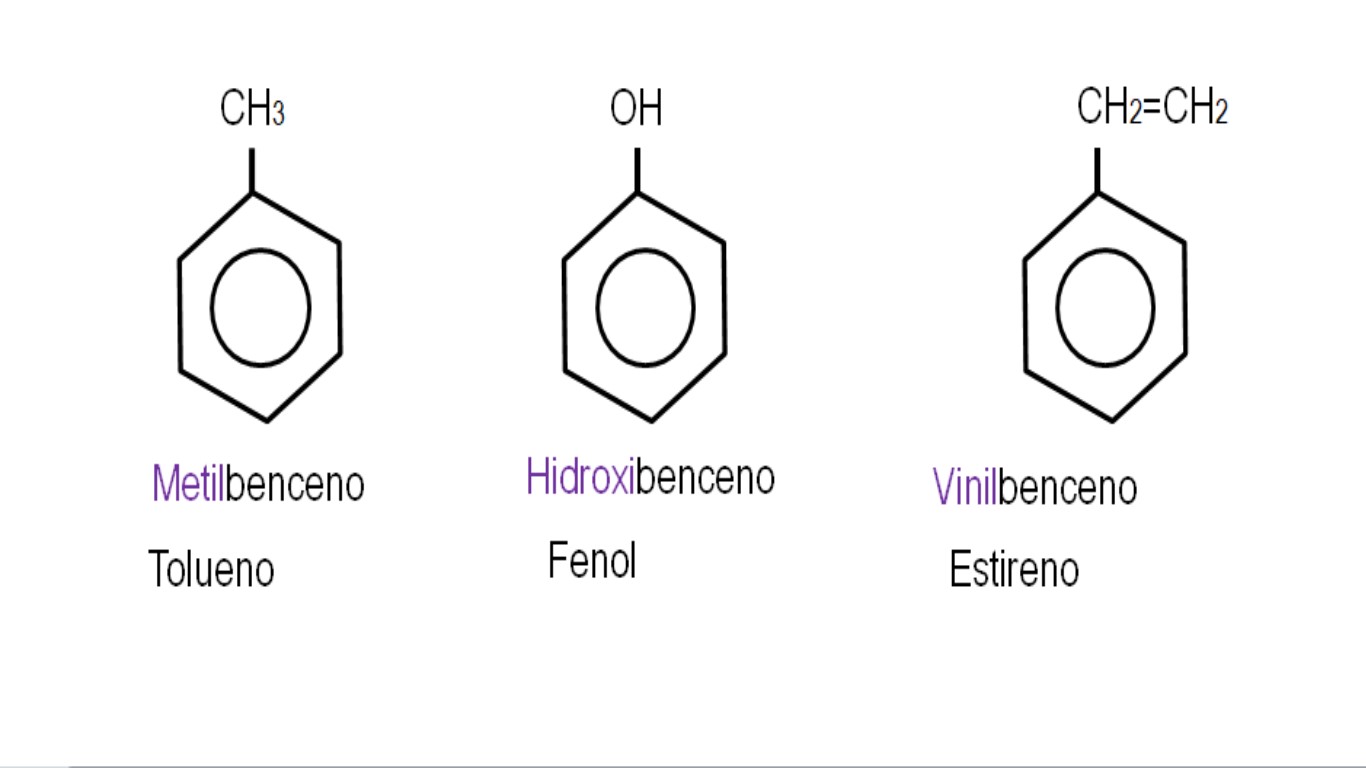
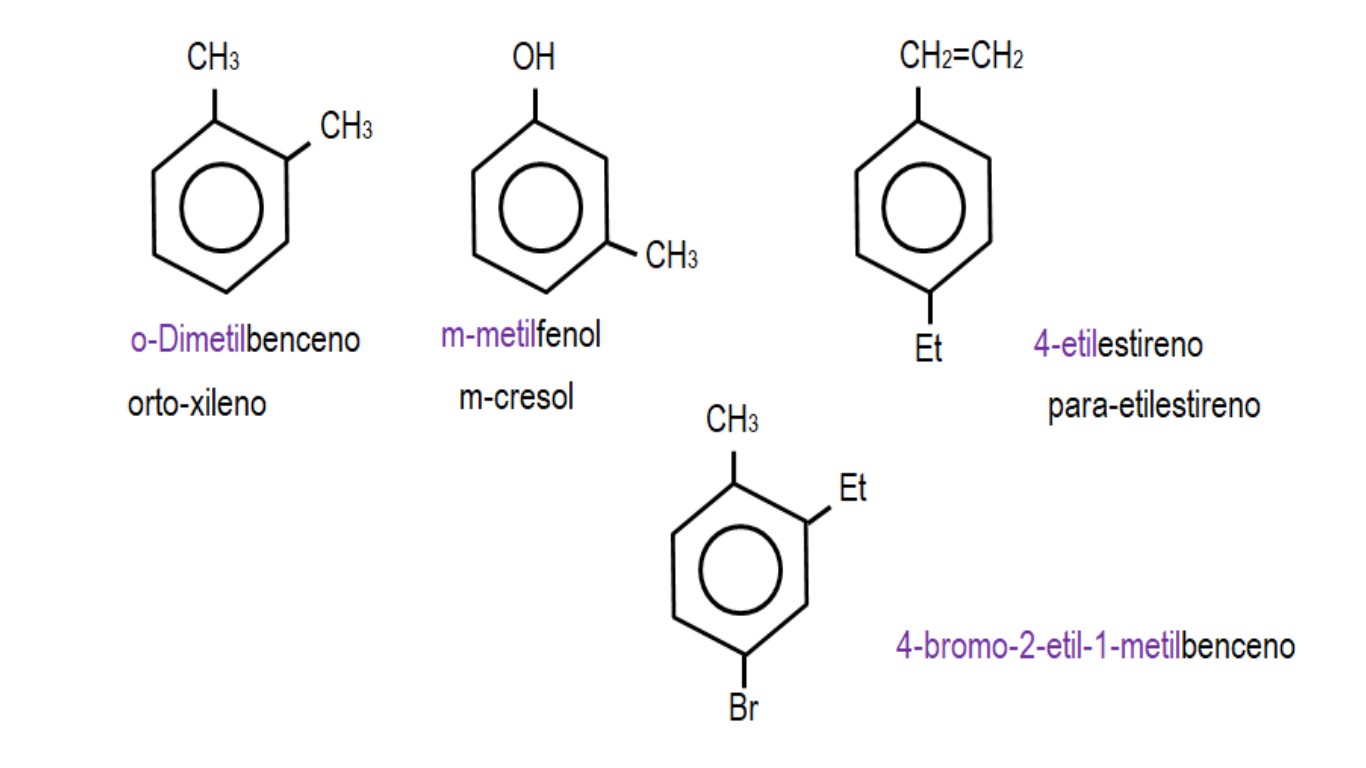
Nótese que en el benceno trisustituido los indicadores orto, para y meta dejan de ser útiles.
El benceno es un compuesto que debe manipularse con cuidado. Dado su particular olor, los efectos negativos inmediatos pueden ser la asfixia, mareos, dolores de cabeza, temblores, somnolencia, nauseas, e inclusive la muerte (ante una elevada exposición). Si se ingiere, además de lo ya mencionado, puede causar agudos dolores de estómago y convulsiones.
Además, los efectos a largo plazo bajo constante exposición a este líquido son cancerígenos; aumenta las probabilidades de que el individuo padezca de algún tipo de cáncer, en especial el de la sangre: leucemia.
En la sangre puede disminuir la concentración de los glóbulos rojos, provocando anemia, y afectar además la médula ósea y el hígado, donde se asimila por el organismo para generar derivados de benceno todavía más tóxicos; por ejemplo, la hidroxiquinona. También se acumula en los riñones, corazón, pulmones y cerebro.
- Morrison, R.T. y Boyd, R. N. (1987). Química Orgánica. (5ta Edición). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Química Orgánica. (6ta Edición). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- National Center for Biotechnology Information. (2019). Benzene. PubChem Database. CID=241, Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzene. Recuperado de: en.wikipedia.org
- Garcia Nissa. (2019). What is Benzene? – Uses, Structure & Formula. Study. Recuperado de: study.com
- Centers for Disease Control and Prevention. (04 de abril de 2018). Facts about benzene. Recuperado de: emergency.cdc.gov
- World Health Organization. (2010). Exposure to benzene: a major public health concern. [PDF]. Recuperado de: who.int
- Fernández Germán. (s.f.). Problemas nomenclatura benceno. Química Orgánica. Recuperado de: quimicaorganica.org
