Catión: formación, diferencias con anión y ejemplos
Un catión es una especie química que tiene carga positiva. Conforma junto al anión los dos tipos de iones existentes. Su carga es producto de una deficiencia de electrones en el átomo, lo que provoca que los protones del núcleo ejerzan una mayor atracción. Por cada electrón que pierda un átomo neutro, se incrementa la carga positiva en una unidad.
Si un átomo pierde un electrón, y por tanto, el número de protones es superior a uno, entonces su carga positiva será de +1; si pierde dos electrones, la carga será de +2, y así sucesivamente. Cuando un catión tiene carga +1 se dice que es monovalente; por otra parte, si dicha carga es superior a +1, se dice que el catión es polivalente.
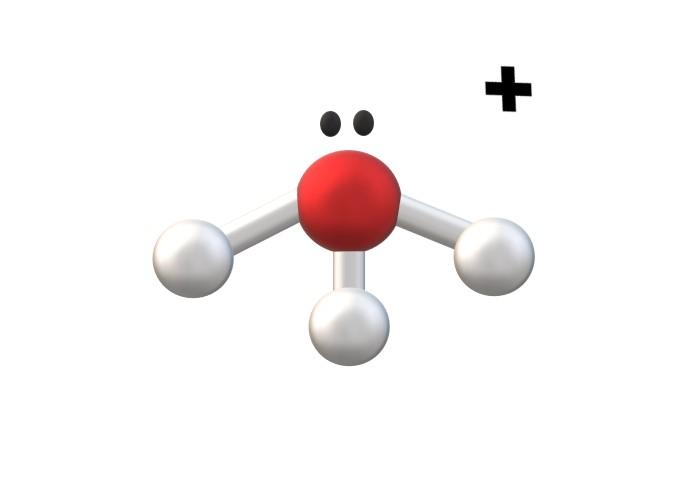
En la imagen superior se muestra al catión H3O+, llamado ion hidronio. Como puede apreciarse, apenas tiene una carga de +1, tratándose en consecuencia de un catión monovalente.
Los cationes son especies importantes, ya que ejercen una fuerza electrostática con su medio y las moléculas alrededor. Presentan una alta interacción con el agua, líquido que los hidrata y transporta en los suelos húmedos, para luego llegar hasta las raíces de las plantas y ser aprovechados para sus funciones fisiológicas.
Índice del artículo
- 1 ¿Cómo se forma un catión?
- 2 Diferencias con anión
- 3 Ejemplos de los cationes más comunes
- 4 Referencias
Se hizo mención de que cuando un átomo pierde un electrón, su mayor número de protones, en relación a los electrones, ejerce una fuerza atracción que se traduce en una carga positiva. Pero, ¿cómo puede ocurrir la pérdida del electrón? La respuesta depende de la transformación ocurrida en las reacciones químicas.
Cabe resaltar que la presencia de un átomo con carga positiva no necesariamente implica la formación de un catión. Para que pueda considerársele como tal, no debe haber un átomo con carga formal negativa que la neutralice. De lo contrario, habría atracción y repulsión dentro de un mismo compuesto y sería neutro.
Los átomos electronegativos atraen los electrones de sus enlaces covalentes hacia ellos. Aunque los electrones se compartan equitativamente, llega un punto en que parcialmente tendrán menos electrones que en su configuración basal; esta es, la de sus átomos libres sin estar enlazados a otros elementos.
Entonces, estos átomos electronegativos comenzarán a experimentar una deficiencia de electrones, y con ello, los protones de sus núcleos ejercerán una fuerza de atracción mayor; nace la carga formal positiva. Si solo hay una carga formal positiva, el compuesto manifestará una carga iónica positiva global; nace así el catión.
El átomo de oxígeno del catión H3O+ es un fiel ejemplo de lo anterior dicho. Al tener tres enlaces O-H, uno más que en la molécula de agua (H-O-H), experimenta de la compartición la pérdida de un electrón respecto a su estado basal. Los cálculos de las cargas formales permiten determinar cuándo sucede esto.
Si se asume por un momento la formación de otro enlace O-H, se obtendrá el catión divalente H4O2+. Nótese que la carga divalente encima del catión se escribe de la siguiente manera: número seguido el símbolo ‘+’; de igual modo se procede con los aniones.
Los metales son formadores de cationes por excelencia. Sin embargo, no todos pueden formar enlaces covalentes (o al menos puramente covalentes). En lugar de ello, pierden electrones para establecer enlaces iónicos: una carga positiva atrae una negativa, unidas por fuerzas físicas.
Por lo tanto, los metales pierden electrones para pasar de M a Mn+, donde n por lo general es igual al número de su grupo en la tabla periódica; aunque n puede tomar varios valores enteros, lo cual ocurre especialmente con los metales de transición. Esta pérdida de electrones se lleva a cabo en un tipo de reacción química llamada oxidación.
Los metales se oxidan, pierden un electrón, el número de protones de sus átomos supera al de los electrones, y exhiben en consecuencia una carga positiva. Para que haya oxidación, tiene que haber un agente oxidante, el cual se reduce o gana los electrones perdido por los metales. El oxígeno es el agente oxidante más conocido de todos.
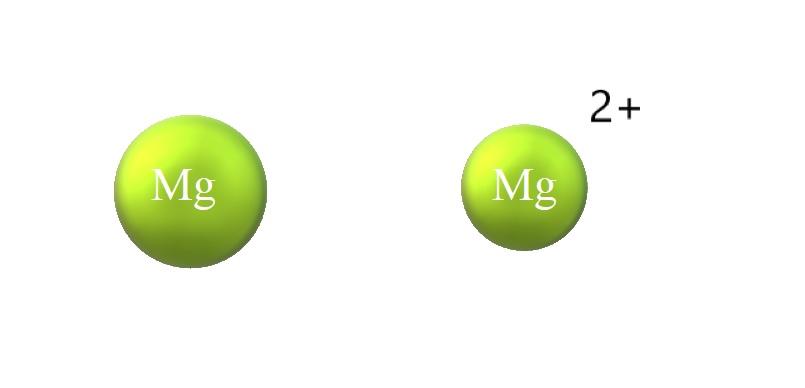
Abajo a continuación se enlistan las diferencias entre un catión y anión:
-El catión en general es más pequeño que el anión. En la imagen superior se muestra cómo se reduce el radio atómico del Mg al perder dos electrones y convertirse en el catión Mg2+; lo contrario ocurre con los aniones: se tornan más voluminosos.
-Tiene más protones que electrones, mientras que el anión tiene más electrones que protones.
-Al ser más pequeño, su densidad de carga es más alta, y por tanto tiene un poder polarizante mayor; esto es, deforma las nubes electrónicas de los átomos vecinos.
-Un catión se desplaza en el mismo sentido que el del campo eléctrico aplicado, mientras que el anión lo hace en sentido contrario.
Los cationes monoatómicos provienen en su mayoría de metales (salvo ciertas excepciones, como el H+). Del resto, es extremadamente raro considerar un catión derivado de un elemento no metálico.
Se verá que muchos de ellos son di o polivalentes, y que las magnitudes de sus cargas concuerdan con el número de sus grupos en la tabla periódica.
-Li+
-Na+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Todos tienen en común la carga ‘1+’, la cual se escribe sin necesidad de colocar el número, y además provienen del grupo 1: los metales alcalinos. Aparte, está el catión Ag+, uno de los más comunes de los metales de transición.
-Be2+
-Mg2+
-Ca2+
-Sr2+
-Ba2+
-Ra2+
Estos cationes divalentes derivan de sus respectivos metales pertenecientes al grupo 2: los metales alcalinotérreos.
-Al3+
-Ga3+
-In3+
-Tl3+
-Nh3+
Cationes trivalentes del grupo de boro.
Hasta aquí los ejemplos se han caracterizado por tener una única valencia o carga. Otros cationes exhiben más de una valencia o estado de oxidación positivo:
-Sn2+
-Sn4+ (estaño)
-Co2+
-Co3+ (cobalto)
-Au+
-Au3+ (oro)
-Fe2+
-Fe3+ (hierro)
Y otros metales, como el manganeso, pueden tener aún muchas más valencias:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Mientras mayor sea la carga, más pequeño y polarizante será el catión.
Sin entrar en química orgánica, existen cationes inorgánicos y poliatómicos que son muy comunes en la vida diaria; tales como:
-H3O+ (hidronio, ya mencionado).
-NH4+ (amonio).
-NO2+ (nitronio, presente en procesos de nitración).
-PH4+ (fosfonio).
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (05 de mayo de 2019). Cation Definition and Examples. Recuperado de: thoughtco.com
- Wyman Elizabeth. (2019). Cation: Definition & Examples. Study. Recuperado de: study.com
- Dummies. (2019). Positive and negative ions: cations and anions. Recuperado de: dummies.com
- Wikipedia. (2019). Catión. Recuperado de: es.wikipedia.org
