Nitrito de potasio (KNO2): estructura, propiedades y usos
El nitrito de potasio es una sal inorgánica cuya fórmula química es KNO2, la cual está relacionada química y farmacológicamente con el nitrato de potasio, KNO3. Su apariencia física consiste de cristales blancos amarillentos, altamente higroscópicos, y por tanto, delicuescentes; es decir, se disuelven rápidamente en ambientes húmedos.
Su fórmula indica que la proporción de los iones K+ y NO2– es 1:1, y permanecen unidos mediante fuerzas electrostáticas o por enlaces iónicos. No se ha encontrado al parecer fuentes naturales puras para sus cristales, aunque los aniones nitritos pueden encontrarse en los suelos, fertilizantes, plantas y animales.

En la imagen superior se muestra cómo lucen los cristales de KNO2, con pronunciadas tonalidades amarillas. Si estos cristales se dejan en contacto con el aire, absorberán humedad hasta convertirse en una solución acuosa; solución que ha generado controversias respecto a si resulta beneficioso o no su uso con fines médicos.
Por otra parte, sus cristales, bajo cantidades muy pequeñas (200 ppm), se utilizan para salinizar las carnes y garantizar su conservación frente a la acción bacteriana. Asimismo, el KNO2 mejora el color de las carnes, tornándolas más rojizas; sin embargo, está sujeto a varias restricciones para evitar los efectos tóxicos de esta sal en el organismo.
Índice del artículo
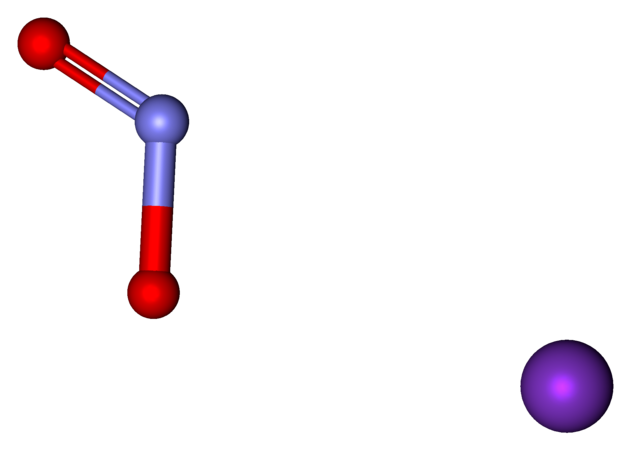
Arriba se muestran los iones presentes en el nitrito de potasio. El catión K+ corresponde a la esfera morada, mientras que el anión NO2– viene representado por las esferas azulada y rojas.
El anión NO2– se muestra con un enlace doble y uno simple [O=N-O]–; pero en realidad, ambos enlaces son iguales producto de la resonancia de la carga negativa entre ellos.
Los iones K+ y NO2– se atraen mutuamente en el espacio hasta organizar un patrón estructural con la menor energía; esta es, donde las repulsiones entre las cargas iguales sean mínimas. Y así crean los cristales KNO2, cuya celda unitaria es susceptible a cambios de temperatura, los cuales transiciones de fase.
Por ejemplo, a bajas temperaturas (menor a 25°C) los cristales de KNO2 adoptan un sistema monoclínico (fase I). Cuando la temperatura sobrepasa los 25°C, ocurre una transición de fase de monoclínico a romboédrico (fase II). Finalmente, por encima de los 40°C los cristales de KNO2 cambian a ser cúbicos (fase III).
Asimismo, el KNO2 puede exhibir otras fases cristalinas (fases IV, V y VI) bajo altas presiones. Con esto, los iones K+ y NO2– terminan moviéndose y ordenándose de diferentes maneras en sus cristales puros.
85,1038 g/mol.
1,9150 g/mL.
440,02°C (pero empieza a descomponerse desde los 350°C, emitiendo humos tóxicos).
537°C (hace explosión).
312 g/ 100 g agua a 25°C.
Su solubilidad en agua es tal, que es higroscópico; tanto, que exhibe delicuescencia, absorbiendo la suficiente humedad para disolverse. Esta afinidad por el agua puede deberse a la estabilidad energética que ganan los iones K+ al hidratarse, así como una baja entalpía de red cristalina para los cristales de KNO2.
Los cristales pueden absorber agua sin disolverse para convertirse en un hidrato, KNO2·H2O. En el hidrato la molécula de agua se encuentra acompañando a los iones, lo cual modifica la estructura cristalina.
Este hidrato (o varios de ellos), pueden formarse por debajo de los -9°C; a mayor temperatura, el agua disuelve e hidrata los iones, deformándose el cristal.
Ligeramente soluble en alcoholes calientes, y muy soluble en amoníaco.
6-9. Sus soluciones acuosas son por tanto alcalinas, ya que el anión NO2– puede hidrolizarse.
Al KNO2 también puede nombrársele de otras maneras. ‘Nitrito de potasio’ corresponde al nombre para esta sal de acuerdo a la nomenclatura stock; ‘nitrito potásico’, según la nomenclatura sistemática, en la que se resalta la única valencia del potasio, +1; y dioxonitrato (III) de potasio, según la nomenclatura sistemática.
El nombre ‘dioxonitrato (III) de potasio’, resalta la valencia +3 del átomo de nitrógeno. Aunque sea el nombre más recomendado por la IUPAC para el KNO2, ‘nitrito de potasio’ continúa siendo el de mayor comodidad y el más fácil de recordar.
La forma más directa para sintetizarlo, pero con menor rendimiento, es mediante la descomposición térmica del nitrato de potasio o salitre a 400°C o más:
2KNO3 => KNO2 + O2
Sin embargo, parte del KNO2 termina descomponiéndose por el calor, además de que se forman otros productos.
Otro método para prepararlo o sintetizarlo con un mayor rendimiento es mediante la reducción del KNO3 en presencia de plomo, cobre o zinc. La ecuación para esta reacción es la siguiente:
KNO3 + Pb => KNO2 + PbO
El nitrato de potasio y el plomo se mezclan estequiométricamente en un sartén de hierro, donde se funden con agitación y calentamiento constantes por media hora. El óxido de plomo (II) es de color amarillo, y la masa resultante se pulveriza en caliente y se trata con agua hirviendo. Luego, la mezcla caliente se filtra.
Al filtrado caliente se le burbujea con dióxido de carbono por cinco minutos, con lo cual se precipitará carbonato de plomo, PbCO3, insoluble. De esta manera se termina de separar el plomo del filtrado. Se le adiciona ácido nítrico diluido al filtrado hasta que el pH sea neutro, se deja enfriar, y finalmente se evapora el agua para que se formen los cristales de KNO2.
El nitrito de potasio se utiliza como aditivo para curar las carnes rojas, manteniendo su sabor y color por mayor tiempo durante su almacenamiento, a la vez que retrasa la acción bacteriana y ciertas toxinas, como la botulínica. Por lo tanto, exhibe acción antibacteriana.
El KNO2 se oxida a NO, el cual reacciona con mioglobina de la carne y, consecuentemente, termina modificando su color rojo natural. Después, cuando la carne se cocina adquiere su característico color rosado fuerte.
No obstante, bajo condiciones sin precisar el KNO2 reacciona con las proteínas de la carne para dar lugar a nitrosaminas, las cuales pueden llegar a ser carcinógenas.
Por otra parte, el KNO2 (aunque preferiblemente NaNO2) es un reactivo analítico que puede utilizarse en la síntesis de colorantes azoicos (la reacción del ácido nitroso con aminas aromáticas), y en el análisis de aminoácidos.
Si bien tiene sus efectos negativos, el KNO2 actúa como un antídoto en pacientes envenenados con cianuros y sulfuro de hidrógeno. Su mecanismo consiste en oxidar los centros de Fe2+ a Fe3+ de los grupos hemos de las hemoglobinas, produciendo metahemoglobina, el cual reacciona seguidamente con los aniones CN– y HS–.
En el jugo gástrico del estómago el anión NO2– se reduce a NO, el cual se sabe que tiene acción vasodilatadora, aumentando el flujo sanguíneo. En otras regiones del organismo donde el pH no es lo suficiente ácido, algunas enzimas, como la xantina oxidorreductasa, se encargan de reducir al NO2–.
Se ha usado el KNO2 para tratar dolencias y enfermedades tales como la angina de pecho y la epilepsia (con efectos secundarios muy negativos).
- Wikipedia. (2019). Potassium nitrite. Recuperado de: en.wikipedia.org
- PrebChem. (2016). Preparation of potassium nitrite. Recuperado de: prepchem.com
- Mark Gilchrist, Angela C. Shore, Nigel Benjamin. (2011). Inorganic nitrate and nitrite and control of blood pressure, Cardiovascular Research, Volume 89, Issue 3, 15 February 2011, Pages 492–498, doi.org/10.1093/cvr/cvq309
- PubChem. (2019). Potassium nitrite. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Formulación Química. (2018). Nitrito de potasio. Recuperado de: formulacionquimica.com
- National Center for Advancing Translational Sciences. (2011). Potassium nitrite. Recuperado de: drugs.ncats.io
- Richard J. Epley, Paul B. Addis, y Joseph J. Warthesen. (1992). Nitrite in Meat. University of Minnesota.
- N. R. Rao, B. Prakash, y M. Natarajan. (1975). Crystal Structure Transformations in Inorganic Nitrites, Nitrates, and Carbonates. Department of Chemistry, Indian Institute of Technology, Kanpur, India.
